PD-1通过与TIM-3配体Gal-9结合而促进PD-1+TIM-3+T细胞的持续存在
在抗肿瘤免疫应答过程中,效应细胞的增殖和活性受免疫检查点共刺激和共抑制信号的平衡调节。然而,肿瘤中持续的抗原刺激会导致T细胞耗竭,这是一种主要由主要调节因子TOX和TCF-1调节的T细胞功能障碍状态,由前体耗竭的T细胞(TCF1+PD-1intTIM-3-)分化为终末耗竭的T细胞(TCF1-PD-1hiTIM-3+),两种T细胞抑制性受体PD-1和TIM-3在T细胞衰竭分化过程中共表达,它们的串扰调节T细胞衰竭和免疫治疗效果。半乳糖凝集素-9(Gal-9)是半乳糖凝集素家族中的一员,具有β-半乳糖的保守碳水化合物识别域(CRDs)。Gal-9调控多种细胞过程,包括TIM-3介导的T细胞死亡。最近的研究发现,PD-1通过与TIM-3配体Gal-9结合而促进PD-1+TIM-3+T细胞的持续存在,并减弱Gal-9/TIM-3诱导的细胞死亡。抗Gal-9疗法选择性地扩增肿瘤内TIM-3+ CD8+ T细胞和免疫抑制调节性T细胞(Treg), 抗Gal-9和刺激性受体GITR的激动性抗体的联合使用可减少Treg细胞的扩增并产生协同抗肿瘤活性。同时,Gal-9的高表达与多发性肿瘤的预后相关,这些都提示Gal-9可能是一个非常有希望的免疫治疗靶点。Gal-9交联PD-1和TIM-3
形成TIM-3/Gal-9/PD-1复合物
Gal-9由两个CRD组成,N-末端CRD(N-CRD)和C-末端CRD(C-CRD),对聚糖具有相似但不同的特异性。结合试验表明Gal-9主要通过其C-CRD与PD-1结合,而N-CRD和C-CRD均介导其与TIM-3的结合,Gal-9/PD-1的相互作用主要由Gal-9的C-CRD和PD-1的N116位连接的聚糖介导。
PD-1与Gal-9的C-CRD优先结合,表明它可以与TIM-3竞争C-CRD结合,形成TIM-3/Gal-9/PD-1复合物。研究发现PD-1 ECD可以有效地与TIM-3 ECD竞争结合Gal-9 C-CRD(Ki=20.47nM)。相比之下,浓度高达10μg/ml的PD-1 ECD不与TIM-3 ECD竞争与Gal-9N的结合。这种竞争将导致TIM-3/Gal-9/PD-1复合物的形成。
来源参考文献1
事实上,研究发现PD-1 ECD在没有Gal-9的情况下不与TIM-3 ECD结合,Gal-9促进了它们的协同结合,如下图所示。
来源参考文献1
Gal-9和TIM-3相互作用最初被报道抑制1型辅助性T细胞(CD4+)免疫,但后来被证明也抑制CD8+T细胞的免疫应答。研究发现,尽管CD4+和CD8+T细胞对Gal-9诱导的细胞死亡敏感,但CD8+细胞毒性T细胞比CD4+T细胞更敏感。
来源参考文献1
Gal-9的凋亡诱导活性需要两个CRD的作用,即使每个CRD本身足以与TIM-3结合。
来源参考文献1
肿瘤中大多数TIM-3+T细胞共同表达PD-1,这些PD-1+TIM-3+T细胞被认为易受Gal-9诱导的凋亡的影响,然而在一些小鼠和人类癌症中,它们仍然存在于TME中,甚至占肿瘤内CD8 T细胞群的主导地位。一种可能是共表达的PD-1抑制Gal-9/TIM-3诱导的T细胞凋亡并促进其持续存在。
体外研究发现,与对照组相比,TIM-3表达使细胞对Gal-9诱导的细胞死亡敏感,当野生型PD-1而非Gal-9结合缺陷型N116Q突变体共同表达时,细胞凋亡减弱。结果表明,共表达PD-1抑制Gal-9/TIM-3诱导的T细胞凋亡,这种抑制需要其多糖介导的与Gal-9的结合。
来源参考文献1
Gal-9诱导的T细胞死亡可能有助于抑制肿瘤免疫。因此,阻断Gal-9在癌症中具有治疗潜力。在大多数人类癌症中,Gal-9表达显著改变,并且Gal-9高表达与多种人类癌症的不良预后相关。
来源参考文献1
在体外,研究发现Gal-9诱导的CD8+T细胞死亡与肿瘤细胞存活相关,表明Gal-9优先杀死T细胞而不是癌细胞可能有助于癌症免疫逃逸。
来源参考文献1
抗Gal-9与GITR激动性抗体
具有协同抗肿瘤作用
Gal-9单克隆抗体RG9-1已被证明能抑制Gal-9与TIM-3的结合,抑制Gal-9诱导的T细胞凋亡。然而,在MC-38同基因小鼠结肠癌模型中,RG9-1单一疗法仅产生中度和短暂的抗肿瘤作用。这可能是由于Gal-9抑制后T细胞共刺激受损所致,因为Gal-9已被证明是肿瘤坏死因子受体超家族(TNFRSF)的T细胞共刺激受体4-1BB的信号传导所必需的。
因此,在抗Gal-9诱导T细胞存活的基础上,可能需要补偿这种共刺激的损失,以提高抗肿瘤免疫反应的质量。研究发现,将抗Gal-9与GITR的激动性抗体(DTA-1)联合,可以协同抑制肿瘤生长并延长总生存期。
来源参考文献1
在另一种同基因肿瘤模型中也验证了联合治疗的效果,该模型具有不同的小鼠品系(BALB/cJ),接种EMT-6小鼠三阴性乳腺癌的原位肿瘤。
来源参考文献1
此外,还研究了抗Gal-9/抗PD-L1联合治疗EMT-6模型的疗效。抗Gal-9和抗PD-L1的联合治疗比单药治疗的存活率更高。
来源参考文献1
为了确定可能影响治疗效果的免疫细胞的变化,研究分析了每个治疗组的肿瘤免疫浸润情况。
来源参考文献1
定量分析表明,在用抗Gal-9治疗的小鼠的肿瘤中,CD4 +T细胞频率(占CD45+细胞总数的%)大约增加了两倍。抗GITR治疗小鼠的样本中有CD4 T细胞下降的趋势。有趣的是,抗Gal-9和抗GITR的组合导致CD4 +T细胞的显著减少。来自对照组和抗Gal-9治疗组的许多肿瘤内CD4 +T细胞共同表达FoxP3和CD25,表明它们是抑制CD8T细胞应答的Treg细胞。
与传统的CD4 T细胞类似,Treg细胞容易受Gal-9诱导的细胞凋亡的影响。在抗Gal-9治疗的小鼠中,这些细胞被抗Gal-9保护导致总CD45+TIL中Treg细胞的频率增加。值得注意的是,抗GITR治疗的小鼠肿瘤内Treg细胞频率显著降低,抗-Gal-9与抗-GITR结合导致Treg细胞几乎完全丧失,表明抗Gal-9拯救的Treg细胞特别容易受到GITR介导的耗竭。这种协同作用的机制非常有趣,还有待阐明。
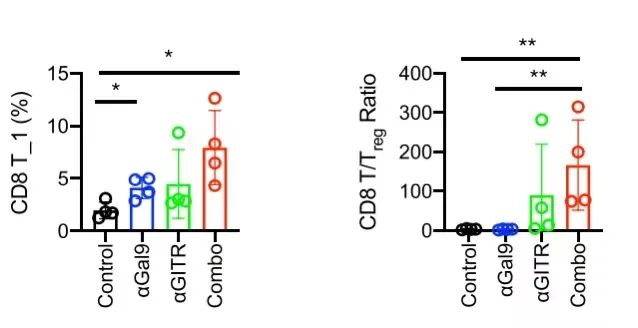
来源参考文献1
此外,抗Gal-9治疗后CD8+T细胞亚群的频率增加了两倍以上。特别是,抗Gal-9和抗-GITR的组合进一步将CD8+T亚群的频率增加了约4倍。由于Treg细胞减少,抗Gal-9和抗GITR组合诱导高CD8 T/Treg细胞比率。这表明了抗Gal-9和抗GITR联合治疗诱导了强烈的免疫应答,可能是观察到的协同抗肿瘤作用的原因。
最新的发现揭示了癌细胞与免疫系统之间错综复杂的战争,揭示了PD-1和Gal-9/TIM-3相互作用导致耗竭性T细胞持续存在的分子机制,并证明Gal-9是未来免疫检查点治疗的一个有希望的靶点。通过合理的设计将抗Gal-9和GITR激动剂联合有可能改善肿瘤患者的预后。在目前以增强T细胞活性为目标的肿瘤免疫治疗的背景下,抑制T细胞死亡与其他治疗方法相结合,尤其是那些减少Treg细胞的治疗方法,可能是一种可行的策略。
参考文献:
1. Galectin-9 interacts with PD-1 and TIM-3 to regulate T cell death and is a target for cancer immunotherapy. Nat Commun. 2021 Feb 5;12(1):832.