近十年来,免疫疗法主要通过抗程序化细胞死亡蛋白1(anti-PD-1)、程序性死亡配体1(anti-PD-L1)和抗细胞毒性T淋巴细胞相关蛋白4(anti-CTLA-4)的单克隆抗体(mAbs)实现了抗癌治疗的革命性进展。然而,仍有一些患者对这些治疗没有反应或产生耐药性。根据最近免疫浸润的肿瘤分类,某些类型的癌症可能对免疫检查点抑制剂(高度免疫浸润称为“热肿瘤”)作出反应,而在其他肿瘤中,可用的免疫疗法似乎无效(非免疫浸润称为“冷肿瘤”)。尽管有几项努力将免疫治疗与其他策略相结合,如化疗、放疗或其他旨在将“冷”肿瘤转化为“热”肿瘤的免疫疗法,但“迫切”需要更好地了解肿瘤微环境的免疫状况,并找到调节免疫功能的替代方法。
除了阻断共抑制途径(如CTLA-4和PD-1介导的途径)外,新的有前景的方法包括激活共刺激途径以增强抗肿瘤免疫反应。其中一种策略包括开发针对肿瘤坏死因子受体超家族(TNFRSF)成员的激动剂抗体,其作用是通过4-1BB、OX40、CD27和糖皮质激素诱导的TNFR相关基因(GITR)在免疫激活和抗肿瘤免疫应答中的作用。多项数据表明,GITR激活可促进效应T细胞功能,而抑制调节性T细胞(Treg)的功能。
GITR(TNFRSF18/CD357/AITR)是属于TNFRSF超家族的一种1型跨膜蛋白,其它成员还包括OX40、CD27、CD40和4-1BB。人GITR在CD4+CD25+FoxP3+Tregs上呈高水平表达,在初始和记忆性T细胞上呈低水平表达。在CD8+和CD4+效应T细胞的激活中,GITR在Tregs和效应T细胞上的表达迅速增加,在激活的Tregs上达到最高水平。GITR在自然杀伤细胞(NK)上也有表达,在B细胞、巨噬细胞和树突状细胞上也有低水平表达,并且可以通过激活上调,尤其是在NK细胞上。
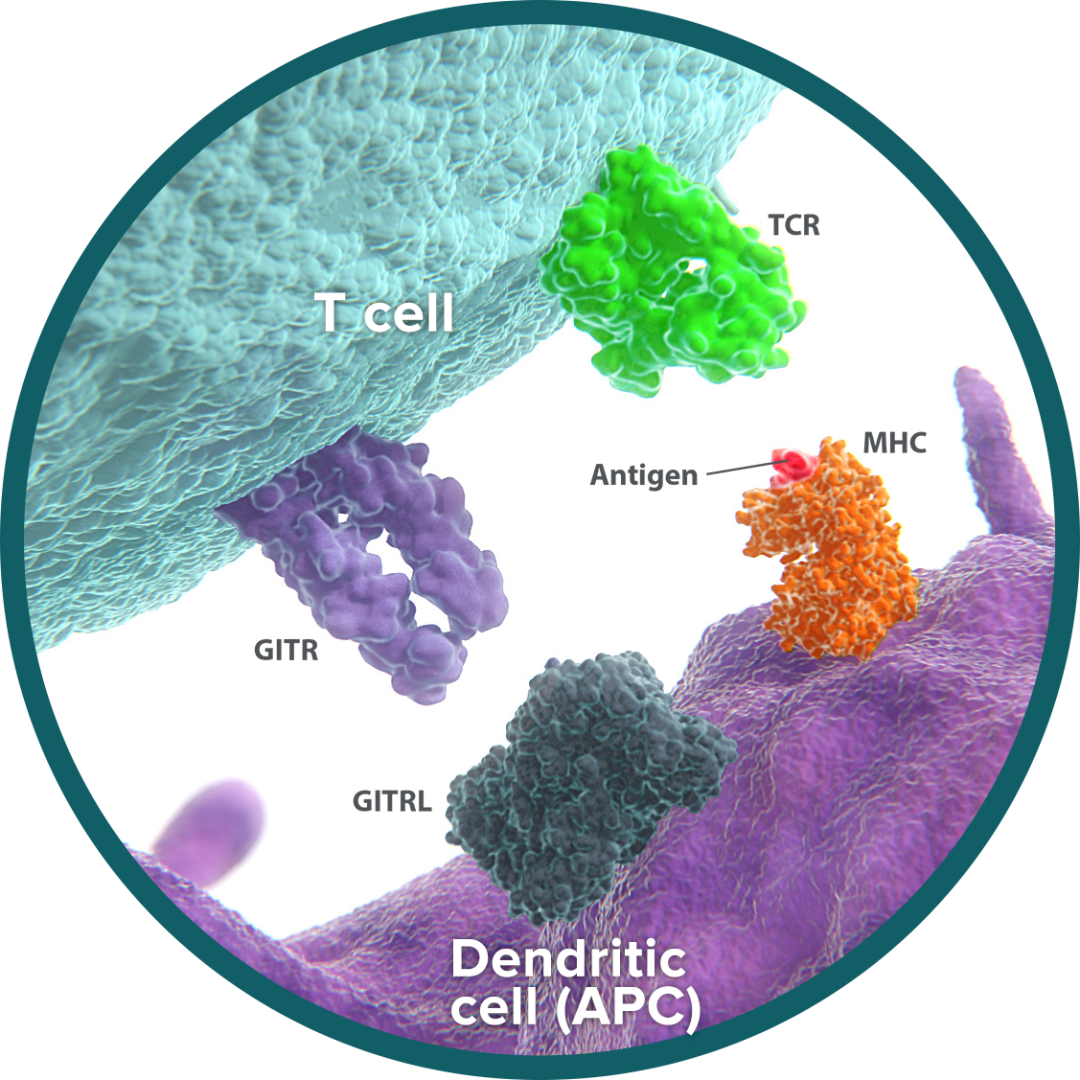
GITRL是一种2型跨膜蛋白,也是TNFRSF的一个成员。它通常被认为是三聚体,尽管它也可以作为单体存在或组装成其他多聚体形式。GITRL主要由活化的抗原提呈细胞表达,包括巨噬细胞、B细胞、树突状细胞和内皮细胞。值得注意的是,GITR和GITRL的表达并不局限于造血细胞,GITR在表皮角质形成细胞和破骨细胞前体细胞上均有表达,而GITRL在内皮细胞上也有表达,尤其是在I型干扰素(IFN)作用后。
最近,鉴定出另一种GITR内源性配体:SECTM1A,它既是跨膜蛋白又是分泌蛋白。在小鼠中,SECTM1A可以同时激活GITR和CD7,但其具体作用尚未确定。
GITR和TNFRSF家族的其他分子,都可以作为共刺激受体,从而成为增强免疫治疗的潜在靶点,尤其是免疫检查点抑制剂。所有TNFR的特点是能够结合TNF配体并通过TNF受体相关因子(TRAFs)激活转录核因子-κB(NF-κB
)通路,TRAFs是一个由六个蛋白质组成的家族,被招募来进一步在细胞内传递信号。特别是,由TRAF2/5-NF-κB介导的GITR信号通路的激活,至少部分是通过上调Bcl-xL促生存分子的表达,导致T细胞凋亡减少并促进T细胞存活。
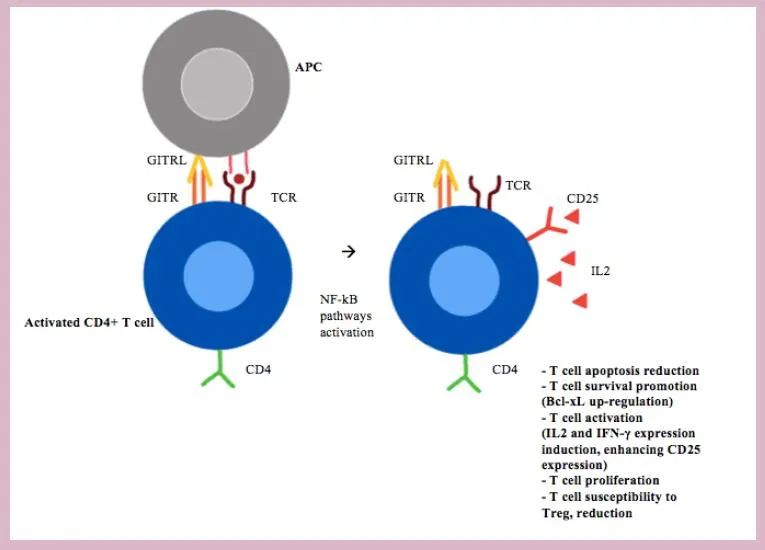
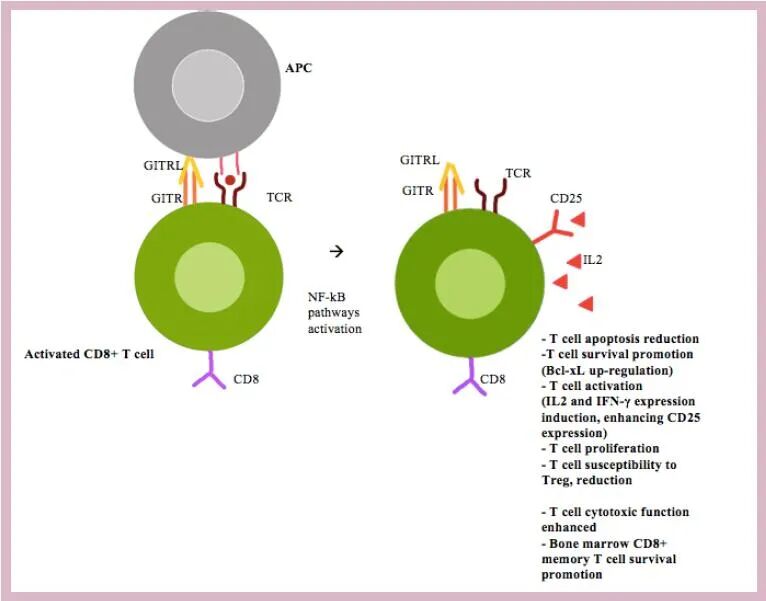
在外周,T细胞受体(TCR)刺激后,传统T细胞上的GITRL或激动剂抗体通过诱导白细胞介素(IL)-2和IFN-γ的表达,增强CD25的表达并刺激细胞增殖来增加T细胞的活化。此外,GITR共刺激增强CD8+T细胞的细胞毒作用,促进骨髓CD8+记忆T细胞存活。
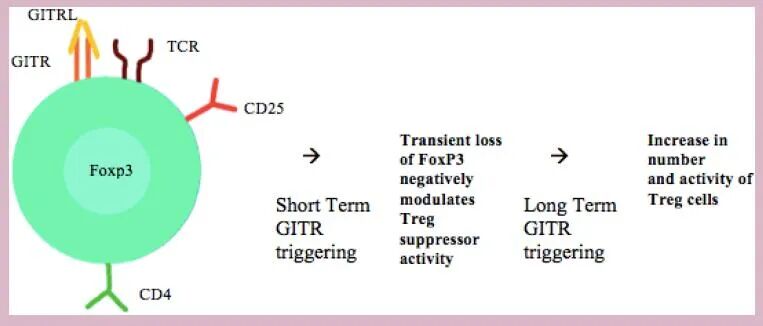
虽然GITR在(CD4+CD25+FoxP3+)Treg细胞中高表达,但其在这些细胞上的功能更为复杂。在体外和体内,GITR信号,特别是由激动剂单抗介导的,可以通过使效应T细胞不易受Treg免疫抑制活性的影响,或通过直接抑制Tregs来抑制效应T细胞的能力。后一种机制可能是由于Tregs上FoxP3的短暂丢失造成的。
有趣的是,GITR/GITRL轴对Treg的作用在短期内似乎是抑制的,而体内长期的过度刺激有利于Treg在小鼠体内的扩增和激活。此外,GITR的共刺激促进了常规T细胞IL-10的产生,有利于常规CD4+T细胞分化为T-helper2和Treg细胞,这些发现支持了GITR在T-helper和Treg细胞之间的平衡作用。
GITR在NK细胞中的作用仍有待确定。总之,虽然通常Treg细胞拮抗效应T细胞,从而限制抗肿瘤活性,但GITR激活效应T细胞通过限制这些细胞对Treg抑制的敏感性来增加效应器功能。
近年来,GITR作为一个药理作用靶点得到了广泛的研究。激动剂单抗激活GITR可增强免疫反应、炎症反应,从而增强抗肿瘤反应。相反,GITR抑制剂会抑制T细胞活化和免疫应答。因此,GITR激动剂单抗被进一步开发为抗肿瘤药物。
在肿瘤模型中,GITR单抗的抗肿瘤活性主要基于增强CD8+和CD4+效应T细胞活性的能力以及对肿瘤浸润Tregs的抑制和耗竭。重要的是,GITR在肿瘤本身不表达,但在几种人类癌症类型的肿瘤浸润淋巴细胞(TILs)上表达,包括肺癌、肾细胞癌、头颈部癌和黑色素瘤。
GITR的单克隆抗体(DTA-1)在多个同基因小鼠肿瘤模型(如黑色素瘤,宫颈瘤)中显示了体内抗肿瘤活性,增强了CD8+和CD4+T细胞增殖和细胞因子诱导。最近的一项研究报道,GITR激动剂还可以增加细胞代谢,以支持CD8+T细胞效应器功能和增殖。CD8+和CD4+T细胞在肿瘤排斥反应中的中间作用似乎至关重要。用DTA-1治疗退行性肿瘤小鼠,发现大量CD4+和CD8+T细胞浸润,包括分泌IFN-γ的T细胞。然而,该治疗仅在IFN-γ完整小鼠中导致肿瘤消退,而不是IFN-γ缺陷小鼠。在CD8+T和NK细胞缺失的情况下,DTA-1的作用丧失或减弱。此外,DTA-1参与的GITR促进了产生IL-9的CD4+T辅助细胞的分化,从而增强了免疫介导的肿瘤反应。
在DTA-1-GITR触发后,抑制肿瘤生长的另一个重要的伴随机制是Treg活性和数量的减少。这种减少可通过Treg特异性和肿瘤特异性抗体依赖性细胞毒性(ADCC)来实现:通过抗GITR单抗的Fc域,肿瘤抗原特异性的GITR+Tregs被肿瘤中的髓细胞和NK细胞识别和杀死。通过对肾癌、结直肠癌和肝癌等肿瘤的癌周区比较发现,GITR在肿瘤浸润性Treg中的表达更高。FoxP3+Treg在肿瘤中的积聚减少也被认为是肿瘤内Treg中FoxP3表达的减少或丢失,以及它们“转化”为激活的T细胞的结果。然而,Mahne等报道mDTA-1消耗而不是转化肿瘤内的Treg。在荷瘤小鼠中,Treg耗竭和GITR触发对于恢复肿瘤内CD8+T细胞衰竭是必要的,从而提高抗肿瘤效果。
Vence等人证实,在GITR单抗治疗后,CD8+和CD4+高表达的肿瘤有更好的反应,主要是肺癌、肾癌和黑色素瘤。此外,初步结果显示瘤内注射比静脉注射更好地抑制肿瘤生长。事实上,瘤内注射能够诱导全身抗肿瘤免疫反应,对注射的和未注射的肿瘤发挥作用。
GITR和其他共刺激分子一样,对T细胞的激活起着关键作用,它的活性可以通过协同作用增强其他抗癌疗法。抗PD-1和GITR激动剂单抗联合治疗可在卵巢癌和乳腺癌小鼠模型中获得长期存活,刺激产生IFN-γ的常规T细胞,抑制免疫抑制的Tregs和髓系来源的抑制细胞。联合疗法成功地恢复了CD8+T细胞的活性,并以CD226依赖的方式诱导前体效应记忆T细胞表型的增殖。此外,有报道抗PD-1/GITR单抗的联合疗法联合化疗或放疗获得了持续响应。
在CT26(结肠癌)和CMS5a(纤维肉瘤)小鼠肿瘤模型中,联合应用GITR单克隆抗体和抗CTLA-4可导致80%的肿瘤响应,减少肿瘤内Treg(通过GITR)和刺激CD8+T细胞(通过CTLA-4)。靶向GITR和OX40激动剂(OX40配体融合蛋白)对CT26荷瘤小鼠表现出意外的协同抗肿瘤作用,尽管联合用药的毒性可能是临床发展的一个限制。
据报道,GITR单克隆抗体与疫苗联合应用可在宫颈癌和黑色素瘤中获得协同和互补的抗肿瘤效果。此外,在疫苗和GITR单抗的联合治疗中添加化疗(吉西他滨)能够减少肿瘤抑制环境,并诱导持久的记忆免疫反应。
总之,在临床前肿瘤模型中,通过激动剂单抗共同激活GITR能够诱导抗肿瘤反应。特别是DTA-1单抗在多个小鼠肿瘤模型中显示了体内抗肿瘤活性,增强了CD8+和CD4+T细胞增殖和细胞因子诱导,并减少了Treg的活性和数量,尤其是通过ADCC。此外,GITR激动剂单抗与其他免疫调节疗法联合应用可获得最佳的抗肿瘤反应。
MEDI1873是一种GITR配体和IgG1FC的激动剂融合蛋白,在一项I期试验中,22.5%的患者报告了G3治疗相关不良事件(TRAEs),没有G4-5 TRAEs。药效学分析证实MEDI1873增加了可评价患者的CD4+Ki67+T细胞,并诱导GITR+/FoxP3+T细胞减少了25%以上。在42.5%患者中达到了疾病稳定,其中17.5%的患者疾病稳定时间超过了24周,这支持进一步的临床试验。
AMG 228是一种激动剂人IgG1-GITR单克隆抗体,其I期试验报告了良好的安全性,但至少在单药治疗没有证据表明T细胞活化或抗肿瘤活性。
BMS-986156是一种完全人源性IgG-GITR单抗,已在I/IIa期试验中进行了单药治疗和与nivolumab联合治疗的试验。单药组34例患者均未出现剂量限制性毒性(DLT)或G3-5级TRAEs,在联合用药的258例患者中有1例出现DLT。虽然联合治疗组在所有肿瘤类型中的客观有效率(ORR)为9%(18/200),但单药治疗无反应。
TRX518是一种完全人源性功能失调的糖基化IgG1κGITR单抗,在I期试验中没有任何反应。药效学数据和随后的体外和体内研究强调了肿瘤对抗GITR单药耐药的可能机制及其联合抗PD-1/PD-L1治疗的可能克服。在小鼠模型中,DTA-1早期治疗可延缓肿瘤生长,阻止肿瘤内T
reg积聚和CD8+未耗尽T细胞上调。不同的是,在晚期肿瘤微环境中,高表达的Treg增加了功能失调的CD8+T细胞,这些细胞表现出疲乏的特征,不能上调激活和细胞毒性的标记物。因此,添加PD-1阻断剂能够抵消CD8+T细胞的耗竭,从而更好地控制肿瘤。在第一批参加I期联合试验的患者中对肿瘤反应的初步评估令人鼓舞(NCT02628574)。
人源性IgG1激动剂GITR单克隆抗体MK-4166与抗PD-1单克隆抗体pembrolizumab联合使用,显示出良好的安全性和潜在的活性,特别是在对治疗不敏感的黑色素瘤患者中。其他正在研究的GITR抗体包括ASP1951(PTZ-522),一种四价单特异性(TM)抗GITR激动剂抗体(NCT03799003);INCAGN01876,一种人源化IgG1单抗(NCT03126110)和GWN323(NCT02740270)。
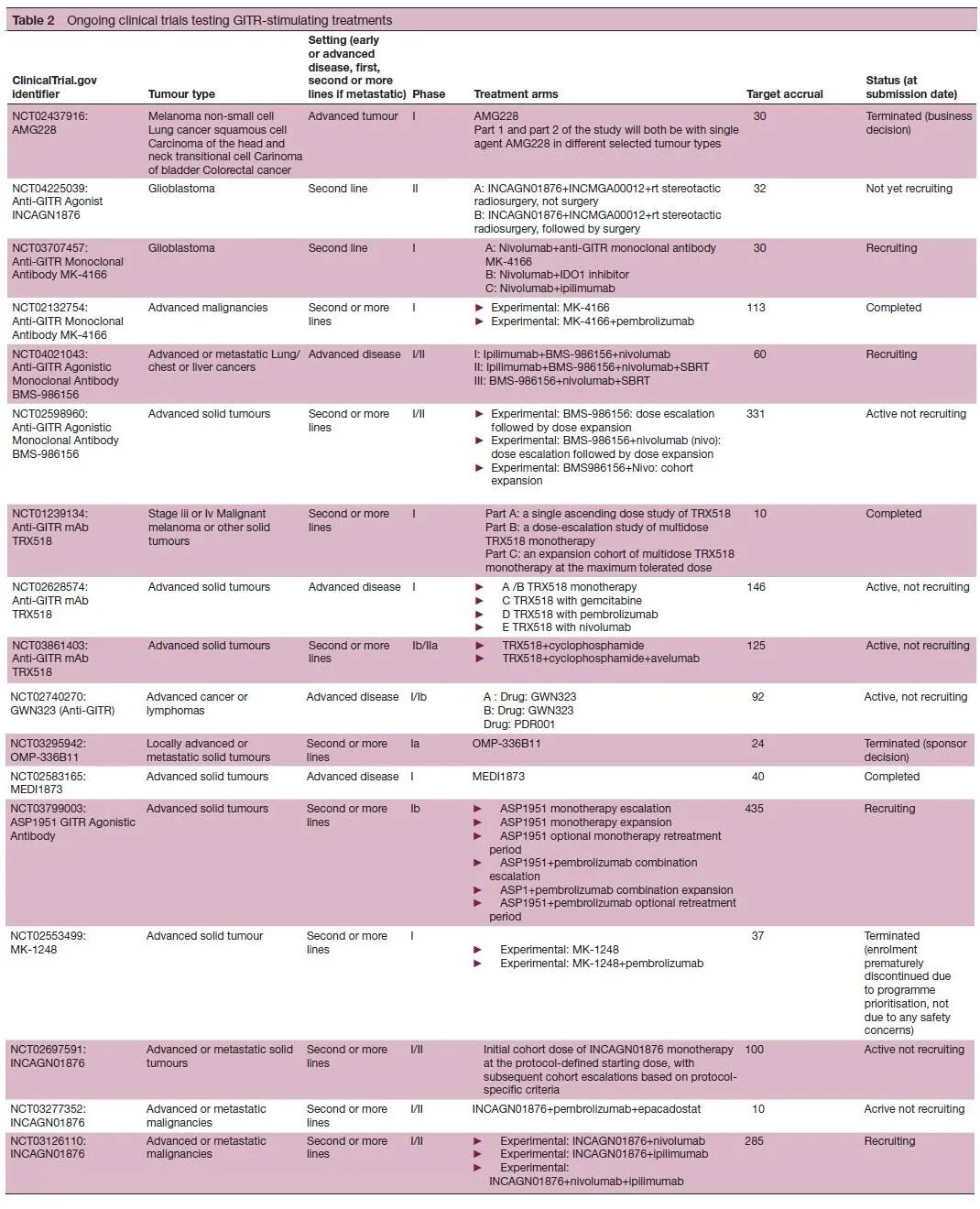
GITR作为一种共刺激受体,代表了增强免疫治疗效果的潜在靶点。临床前资料证实,触发GITR可增加CD8+和CD4+效应T细胞活性,减少肿瘤浸润Tregs。GITR单克隆抗体具有可接受的安全性。然而,尽管在I/II期试验中使用免疫检查点抑制剂的联合治疗看到了疗效,但是它们似乎不能作为单一疗法起效。能够看到的是,通过转化CD8+T细胞衰竭,加入PD-1阻断剂可能具有协同和互补的抗肿瘤作用。目前,一些临床研究正在进行中,特别是与其他治疗相结合,期待开发GITR刺激疗法能够获得进一步利好的结果。
参考文献:
1.New emerging targets in cancer immunotherapy: the role of GITR. ESMO Open. 2019; 4(Suppl 3): e000738.
小编为大家收集了JP Morgan大会上各公司的演讲PPT40份,以获取大会上的热点新闻和未来风向。
扫码登记信息,即可领取下载地址!
扫 码 领 取
识别微信二维码,添加抗体圈小编,符合条件者即可加入抗体圈微信群!

本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系(cbplib@163.com),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。
