
据 Insight 数据库统计,本周(3 月 12 日-3 月 18 日)全球共有 42 款创新药(含改良新)研发进度推进到了新阶段,其中 2 获批上市,1 款申报上市,11 款获批临床,13 款申报临床。
下文中,Insight 将分别摘取国内外部分重点项目做介绍。
国内部分,本周共有 46 款创新药(含改良新)研发进度推进到了新阶段,其中 3 款获批上市,1 款申报上市,13 款获批临床,16 款申报临床。本周国内首次启动临床的 8 款创新药(含改良新)
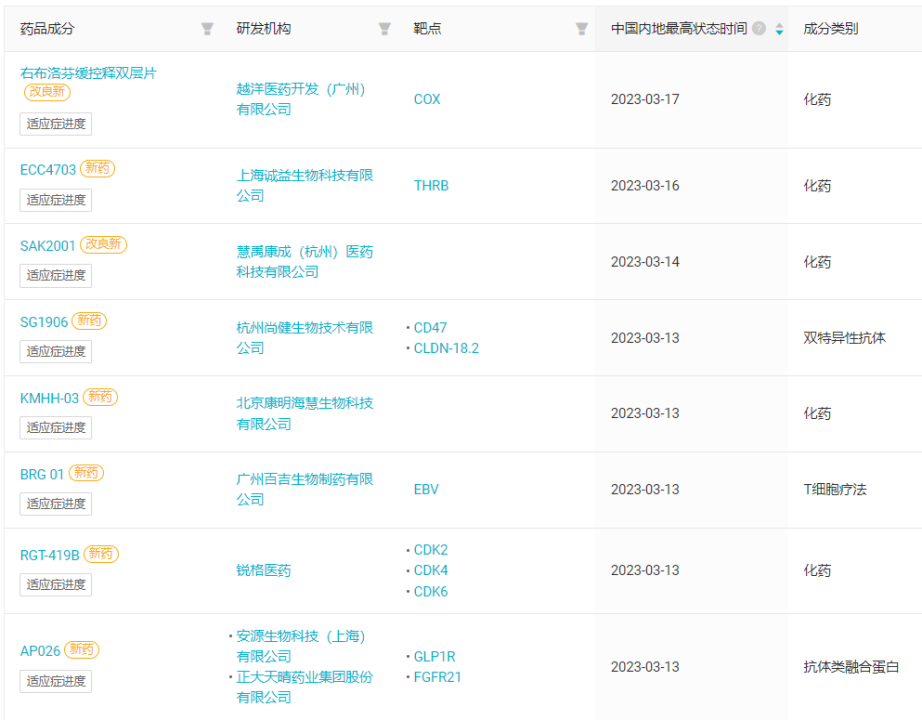
来自:Insight 数据库网页版
以下图片如无特殊说明,均来自 Insight 数据库
1、拜耳 AR 抑制剂「达罗他胺」新适应症国内获批3 月 16 日,据 NMPA 官网显示,拜耳口服雄激素受体抑制剂(ARi)「达罗他胺片」新适应症国内获批上市,联合多西他赛治疗转移性激素敏感性前列腺癌(mHSPC)成年患者(受理号:JXHS2200041)。
此前,于 2021 年 2 月达罗他胺已在国内获批用于治疗有高危转移风险的非转移性去势抵抗性前列腺癌(NMCRPC)成年患者。
去年 8 月, 拜耳宣布,FDA 已批准其口服雄激素受体抑制剂(ARi)达罗他胺(darolutamide)联合多西他赛的补充新药申请(sNDA),用于转移性激素敏感性前列腺癌(mHSPC)患者的治疗。
此次 FDA 的批准基于一项 III 期 ARASENS 试验的积极结果。这是一项随机、3 期、多中心、双盲、安慰剂对照试验,旨在前瞻性地研究达罗他胺与化疗药物多西他赛和 ADT 疗法联合治疗 mHSPC 患者的安全性和有效性。
试验共纳入 1306 例新确诊患者。结果表明,与 ADT 加多西他赛相比,达罗他胺联合 ADT 和多西他赛可显著降低 32.5% 的死亡风险。
前列腺癌细胞的生长具有雄激素依赖性,故转移性前列腺癌患者最初对雄激素剥夺治疗(ADT)治疗敏感,即 mHSPC。持续 ADT 治疗后仍然疾病进展的患者会发展为转移性去势抵抗性前列腺癌(mCRPC)。
除了美国、中国大陆外,拜耳此前已向欧洲药品管理局(EMA)、日本厚生劳动省(MHLW)提交了申请,计划在全球范围内提交更多关于针对 mHSPC 适应症的监管申请。
在前列腺癌领域,拜耳开展了 6 项 III 期临床研究,包括当前尚未开始招募的 ARASAFE 研究以及 ALADDIN 研究。
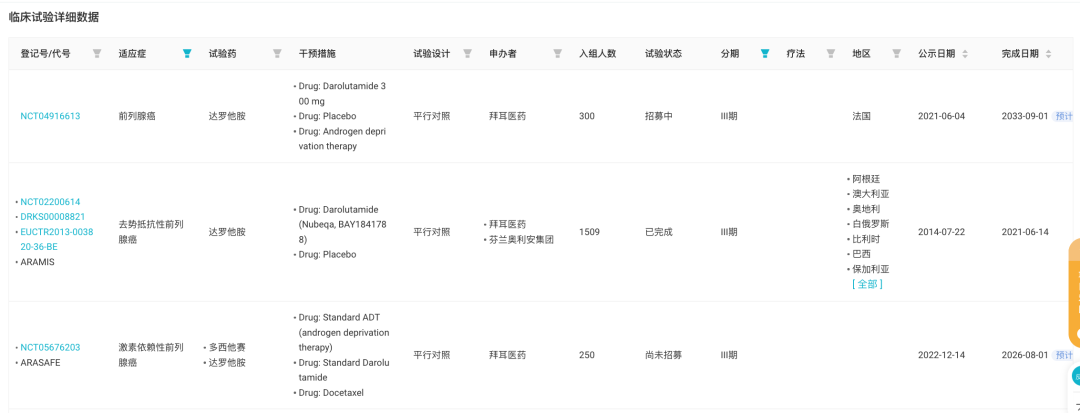
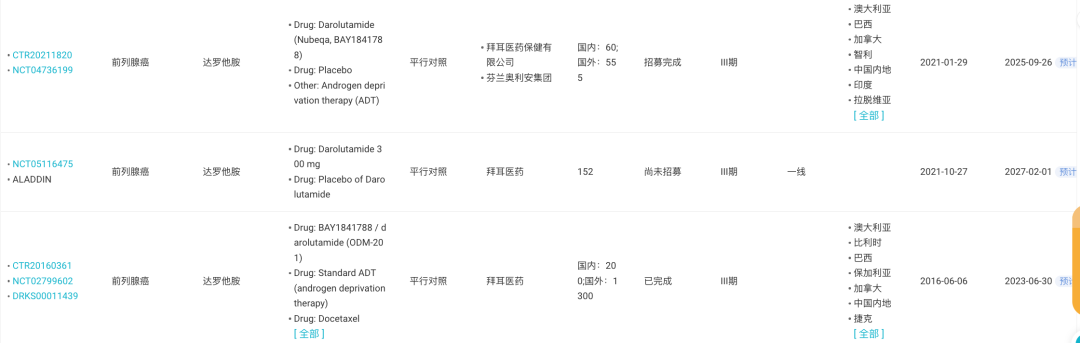
来自:Insight 数据库
除前列腺癌外,当前拜耳正在探索达罗他胺其他适应症,如正在日本开展唾液腺癌的 II 期临床试验(登记号:NCT05694819)。
来自:Insight 数据库
达罗他胺是一种口服雄激素受体抑制剂,具有独特的化学结构,与雄激素受体高亲和力结合,表现出较强的拮抗活性,从而抑制受体功能和前列腺癌细胞的生长。该药由拜耳和 Orion 公司联合开发,当前已经在包括美国、欧盟、日本等在内的全球 70 多个国家和地区获得批准。
2、国内首款!「右美托咪定鼻喷雾剂」获批上市
3 月 16 日,据 NMPA 官网显示,恒瑞盐酸右美托咪定鼻喷雾剂获批上市(受理号:CXHS2101042),用于治疗成人术前镇静(如成人全身麻醉),为国内用于术前镇静的首款鼻喷制剂。
除术前镇静之外,恒瑞针对儿童群体也有布局,去年 9 月,恒瑞曾发布公告表示右美托咪定鼻喷雾剂的上市申请获 CDE 受理,并被 CDE 作为符合儿童生理特征的儿童用药品新品种、剂型和规格纳入拟优先审评品种公示名单。
盐酸右美托咪定鼻喷剂由恒瑞医药自主研发,属于改变给药途径且尚未在国内外上市的制剂。相比注射剂,鼻喷雾剂生物具有利用度高、给药方便等优点,尤其适用于儿童。
截至目前,据 Insight 数据库显示,国内外暂无盐酸右美托咪定鼻喷雾剂上市。除恒瑞外,另有四川普锐特药业的同类产品已于去年 8 月在国内申报上市。此外,宜昌人福药业亦有布局,目前正在开展 I 期临床研究。
3、云顶新耀:依拉环素在中国获批,治疗成人复杂性腹腔内感染
3 月 16 日,云顶新耀宣布中国国家药品监督管理局(NMPA)已批准依嘉®(XERAVA™,依拉环素)的新药上市许可申请,用于治疗成人复杂性腹腔内感染(cIAI)。该公司计划于今年三季度在中国启动依嘉®的商业化上市。
复杂性腹腔内感染(cIAI)是一种院内或社区获得性感染,由空腔脏器延伸到腹膜腔形成的腹膜炎或者脓肿的感染疾病,包括腹腔脓肿、胃或肠穿孔、腹膜炎、阑尾炎、胆囊炎、憩室炎等。cIAI 由不同的病原体引起,包括革兰阴性菌、革兰阳性菌和厌氧菌。
2018 年,中国大陆约有 290 万 cIAI 患者,因耐药菌导致的感染率不断攀升,限制了现有抗菌药物使用的有效性。
依嘉®(XERAVA™,依拉环素)是一种新型、全合成、广谱、含氟四环素类、静脉注射抗菌药物,用于治疗包括在中国常见的革兰阴性菌、革兰阳性菌感染在内的多重耐药(MDR)菌感染的一线经验性单药治疗。
依嘉目前已在美国、欧盟、英国、新加坡和中国香港被批准用于治疗复杂性腹腔内感染(cIAI),在中国台湾地区治疗复杂性腹腔内感染的上市许可申请正在审理中。依嘉®是云顶新耀从Tetraphase制药公司(为Innoviva, Inc.的全资子公司)授权引进。
依拉环素全球项目开发关键节点
来自:Insight 数据库网页版
1、齐鲁锐格 CDK2/4/6 抑制剂国内首次启动临床3 月 13 日,据 Insight 数据库显示,齐鲁锐格的 CDK2/4/6 抑制剂 RGT-419B 国内首次启动临床。
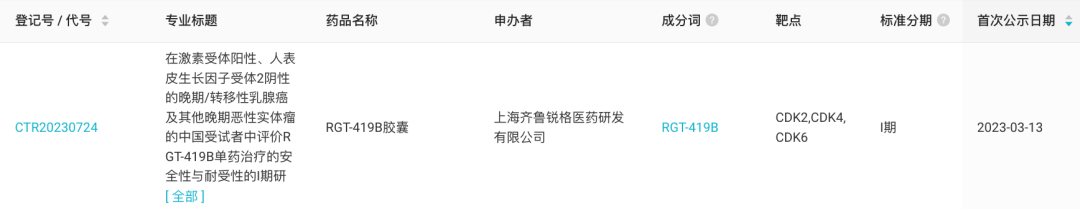
来自:Insight 数据库
RGT-419B 在国内于 2022 年 2 月首次申报临床,同年 4 月获批,并于今日启动临床。而此前在去年 2 月已在 ClinicalTrials.gov 上登记了一项 I 期临床研究,当前正在美国开展(登记号:NCT05304962)。RGT-419B 全球项目开发关键节点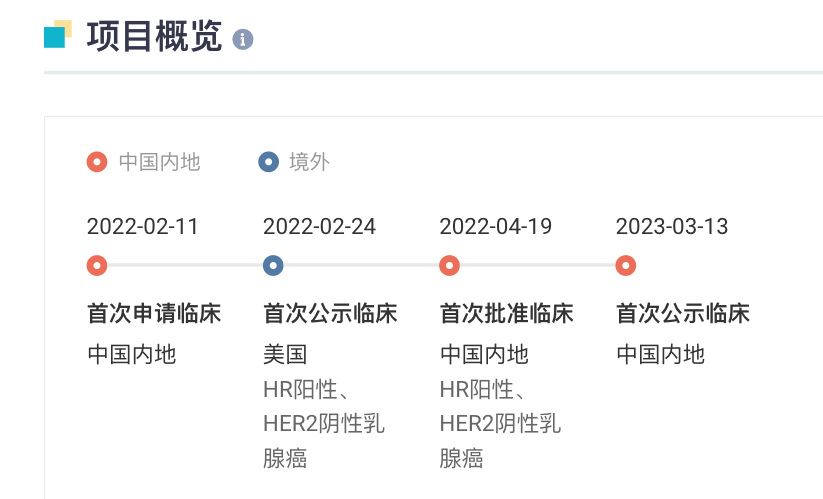
来自:Insight 数据库网页版
RGT-419B 是新一代 CDK2/4/6 小分子抑制剂,具有优化的激酶活性谱。它有望改善目前已获批准的 CDK4/6 抑制剂的安全性,并克服对这些抑制剂的耐药性,这些抑制剂与内分泌疗法联合使用,治疗绝经前/绝经后的激素受体阳性(HR+)、人类表皮生长因子受体 2 阴性(HER2-)的晚期或转移性乳腺癌患者。在细胞模型实验中,RGT-419B 显示出单药活性,与 abemaciclib 和 palbociclib 相比,对 ER+肿瘤细胞生长的抑制作用更大。在对目前批准的 CDK4/6 抑制剂耐药的 ER+乳腺癌细胞中,RGT-419B 显示出对癌细胞增殖的完全抑制。在这些实验中,RGT-419B 与选择性雌激素受体降解剂或 PI3K 信号通路抑制剂联合使用时,其对肿瘤细胞的抑制作用进一步增强。作为单药和与其他获批疗法联合使用,RGT-419B 最初将被开发用于治疗对目前获批的 CDK4/6 抑制剂有原发或获得性耐药的 HER2-、ER+乳腺癌患者。随着 CDK4/6 抑制剂在临床实践中被广泛采用,以前用 CDK4/6 抑制剂治疗的难治和复发患者正成为更大的、具有临床意义的未满足医疗需求。RGT-419B 的临床开发项目将解决这种对 CDK4/6 和其他激素受体调节疗法的耐药性,为改善晚期乳腺癌患者的生存和生活质量提供新的机会。RGT-419B 是锐格医药公司正在开发的众多创新肿瘤药物中的第一个。
HER2-/HR+乳腺癌是最常见的乳腺癌类型。在全球范围内,乳腺癌是最常见的癌症之一,在 2020 年影响约 230 万妇女,是妇女因癌症死亡的主要原因。在中国,乳腺癌在实体瘤类型中排名第四,每年有超过 40 万新病例。乳腺癌给中国和全世界患者带来了巨大的医疗负担,并对患者及其家庭带来巨大负面影响。锐格医药(Regor Therapeutics)是一家处于临床阶段的生物医药高科技公司。成立三年半以来,凭借自身 AI 辅助新药研发 CARD 平台锁定制药界「久攻不下」的靶点并开发具有临床差异化优势的创新药物。公司聚焦肿瘤、免疫和代谢三大治疗领域,目前共有 3 款进入临床阶段的新药,RGT-075 是进展最快的一款,属于小分子 GLP-1R 激动剂,已经进入 II 期临床,属于全球第一梯队。2021 年 12 月 10 日,礼来以最高 15 亿美元与锐格医药达成合作,共同开发代谢领域新药,重点项目即为用于糖尿病和肥胖症的 RGT-075。锐格医药官网管线
2、中生尚健:CD47/CLDN18.2 双抗启动临床
3 月 13 日,据 Insight 数据库显示,尚健生物自主研发的靶向 CLDN18.2/CD47 创新双抗项目 SG1906 注射液首次启动临床,适应症为 CLDN18.2 阳性晚期恶性实体肿瘤(登记号:CTR20230722)。

来自:Insight 数据库
SG1906 是基于尚健生物 BIMA 双抗平台研发的抗 CLDN18.2/CD47 创新双抗。SG1906 能同时特异性结合CLDN18.2/CD47 分子,介导抗体依赖性细胞介导的细胞毒性(ADCC)、抗体依赖性细胞吞噬作用(ADCP)以及通过阻断 CD47 和 SIRPα 相互作用,解除对巨噬细胞的免疫抑制,增强抗体依赖性细胞介导的吞噬作用,提升巨噬细胞对肿瘤细胞的吞噬作用,发挥协同抗肿瘤效应。CLDN18.2(Claudin18.2)是一种紧密连接蛋白,广泛表达于上皮和内皮细胞,维持细胞极性和屏障功能以及选择通透功能。正常情况下 Claudin18.2 仅在胃上皮细胞中表达,具有高度的组织特异性;发生癌变时,Claudin18.2 在多种肿瘤组织中高度表达。除与胃恶性肿瘤密切相关外,在胰腺、食管、肺部等多种肿瘤中均被证实存在异常表达。正常情况下,Claudin18.2 蛋白仅在埋藏在胃黏膜上已分化的上皮细胞中表达,而恶性肿瘤的发生会破坏紧密连接,使肿瘤细胞表面的Claudin18.2 分子暴露出来,成为特定靶点。因而Claudin18.2 被看作具有巨大潜力的抗肿瘤靶点,目前靶向Claudin18.2 的在研药物涵盖了抗体、CAR-T 和ADC 等多种类型。
CD47/SIRPα 是后 PD-1/PD-L1 时代肿瘤免疫领域中最重要的靶点之一。特异性抗体等药物阻断 CD47/SIRPα 信号通路,可解除免疫抑制,恢复巨噬细胞对肿瘤细胞的吞噬活性,解除「别吃我」信号,发挥强大的肿瘤免疫治疗效应。全球针对CD47-SIRPα 通路开发处于临床阶段的药物已超过 30 个,与多种肿瘤治疗策略联合用药呈现积极进展。SG1906 采用 CLDN18.2 端高亲和力和弱化 CD47 端亲和力的差异化分子设计,以重定位 SG1906 在患者体内的靶向分布,从而在发挥联合抗肿瘤药效的同时降低 CD47 靶点的血液系统安全性风险。非临床研究显示,SG1906 抗肿瘤作用明确,可发挥「1+1>2」的协同效应,在 CLDN18.2 中低表达的 PDX 肿瘤模型中显示出积极的抑瘤效果;SG1906 安全性良好,未见明显的靶点相关不良反应。SG1906 拟用于治疗 CLDN18.2 阳性晚期恶性实体肿瘤。SG1906 此前已于 2022 年 10 月获得美国 FDA 批准临床试验。
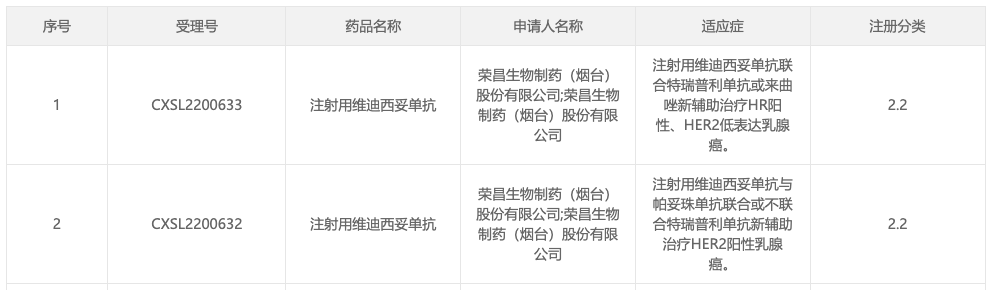
1、乳腺癌新辅助疗法!荣昌生物 RC48 获批两项临床试验3 月 15 日,据 CDE 官网显示,荣昌生物 RC48 /维迪西妥单抗获批两项乳腺癌新临床试验,分别为:
- 联合特瑞普利单抗或来曲唑新辅助治疗 HR 阳性、HER2 低表达乳腺癌(受理号:CXSL2200633);
- 与帕妥珠单抗联合或不联合特瑞普利单抗新辅助治疗 HER2 阳性乳腺癌(受理号:CXSL2200632)。
来自:CDE 官网
以胃癌和尿路上皮癌开路的维迪西妥单抗,目前正积极探索乳腺癌适应症的开发。在此之前,维迪西妥单抗已启动两项治疗乳腺癌的 III 期临床试验,分别针对 HER2 阳性乳腺癌肝转移(登记号:CTR20180492)以及 HER2 低表达乳腺癌(登记号:CTR20200646)。
维迪西妥单抗治疗乳腺癌适应症临床试验

来自:Insight 数据库网页版
除维迪西妥单抗之外,德曲妥珠单抗(T-DXd,DS-8201a)的乳腺癌新辅助治疗临床研究也同样在中国推进中。
针对 HER2 阳性乳腺癌,T-Dxd 当前正在开展 III 期 DESTINY-Breast11 临床试验(登记号:CTR20220458/NCT05113251)。该研究已于 2021 年完成首例国外受试者的入组工作,并于去年 7 月完成国内首例入组工作。
针对 HR 阳性、HER2 低表达乳腺癌新辅助疗法,第一三共/阿斯利康也有探索,此前已在 2022 SABCS 会议上首次公布了 T-DXd II 期临床 TALENT 试验(登记号:NCT04553770)结果。该研究旨在评估 T-DXd 单药或联合内分泌疗法新辅助治疗 HR+/HER2 低表达早期乳腺癌患者的临床疗效和安全性。研究纳入既往未接受过治疗,癌灶为可手术的早期浸润性、非复发性病灶,分子亚型为 HR+/HER2 低表达 (IHC 1+或 IHC 2+/ISH-),病灶 >2 cm 的患者。主要终点为为患者手术时的 pCR 率 (ypT0/is ypN0)。研究共纳入 58 名受试者。在主要终点方面,T-DXd 单药治疗组中完成研究治疗并接受了手术的 17 例患者中,有 1 例患者在 8 个周期治疗后达到 pCR(即 RCB-0 级),2 例患者在 6 个周期治疗后达到 RCB-1 级 (即可见少量病灶残留)。在 ORR 方面,T-DXd 单药治疗组可评估患者的 ORR 为 75%,其中 1 例为完全缓解 (CR)、11 例为部分缓解 (PR);T-DXd 联合内分泌治疗组可评估患者的 ORR 为 63.2%(12/19),其中 2 例为 CR、10 例为 PR,此外 B 组有 1 例患者发生疾病进展 (PD)。在安全性方面,有 1 例患者 (1.7%) 发生 2 级间质性肺病 (ILD),在停止治疗 11 天后消退。荣昌之外,国内企业中还有浙江医药的 HER2 ADC ARX788 也在开展乳腺癌新辅助治疗 II/III 期临床研究(登记号:NCT05426486)。该试验于去年 5 月启动,预计招募 150 名受试者,当前正在招募中,预计主要指标于 2025 年 12 月完成。NCT05426486 试验信息
2、复宏汉霖抗 OX40 抗体 HLX51 获批临床3 月 15 日,复宏汉霖宣布,公司自主开发的创新型抗 OX40四价激动型人源化单克隆抗体 HLX51 获国家药品监督管理局(NMPA)批准在中国开展 I 期临床研究,拟用于晚期/转移性实体瘤和淋巴瘤的治疗。目前,全球范围内尚无靶向 OX40 的产品获批上市。近年来,免疫疗法为肿瘤治疗提供了新的途径,具有独特的优势和巨大的潜力,而肿瘤免疫检查点是免疫治疗中的重要组成部分。免疫检查点主要分为两大类,一类是以 PD-1/PD-L1、CTLA-4 为代表的免疫抑制型检查点,另一类是以 OX40(肿瘤坏死因子受体超家族成员 4)为代表的免疫激动型检查点。OX40 又称 CD134、TNFRSF4,是肿瘤坏死因子受体(TNFR)超家族成员,主要表达于活化的 T 细胞表面。OX40 与其配体OX40L 结合可释放共刺激信号,抑制活化诱导的细胞死亡(activation induced cell death,AICD),并促进抗原特异性记忆 T 细胞的存活。与免疫检查点抑制剂通过解除 T 细胞活化的抑制性信号、为肿瘤免疫反应「松刹车」的作用不同,靶向免疫激动型检查点的免疫检查点激动剂可通过「踩油门」增强 T 细胞的活化,目前已成为下一代免疫治疗热门靶点。
HLX51 是复宏汉霖自主研发的抗 OX40 激动型人源化单克隆抗体。HLX51 通过与 OX40L 竞争性结合 OX40,可代替OX40L 刺激 OX40,而不会降低 OX40 刺激信号,从而刺激 T 细胞增殖/活化,进而诱导或增强 T 细胞的杀伤能力;此外,还可以抑制调节性T细胞(Treg)细胞增殖及激活,解除 Treg 细胞介导的免疫抑制功能,改善肿瘤微环境中的免疫抑制作用,进一步促进T 细胞释放细胞因子,从而发挥更强的抗肿瘤作用。
临床前研究结果显示,HLX51 可显著抑制肿瘤生长,具有良好的耐受性和安全性。
境外部分,本周共有 5 款创新药(含改良新)研发进度推进到了新阶段,其中 3 款获批临床,1 款申报临床。1、NSCLC:默沙东 PD-1+TIGIT 复方制剂 II 期研究未达到 PFS 终点3 月 16 日,默沙东宣布 PD-1+TIGIT 复方制剂 MK-7684A 治疗转移性非小细胞肺癌(NSCLC)的 II 期非注册 KeyVibe-002 研究的最新结果未达预期。
KeyVibe-002 研究旨在评估 PD-1+TIGIT 复方制剂 MK-7684A 治疗转移性复发性非小细胞肺癌的疗效。
开放标签部分显示,与多西他赛治疗组相比,MK-7684A 单独治疗在无进展生存期(PFS)的主要终点上未达到统计学意义的改善,且在数值上 MK-7684A 疗效不如多西他赛。默沙东决定后续的治疗全部转为标准治疗,除非医生认为MK-7684A治疗有获益的患者。该研究将继续评估 MK-7684A 联合多西他赛相较于多西他赛单药的疗效。在安全性方面,MK-7684A 的安全性与 vibostolimab 和帕博利珠单抗的安全性一致,未观察到新的安全信号。据 Insight 数据库显示,当前 MK-7684A 正在开展 5 项 III 期临床研究,除 NSCLC 外,另有针对小细胞肺癌以及黑色素瘤。
2、杨森 IL-23 抑制剂长期真实世界数据积极结果公布3 月 18 日,强生宣布,根据对真实世界数据分析,其白介素(IL)-23 抑制剂 Tremfya(guselkumab,古塞奇尤单抗)在治疗生物初治(bio-naïve)和具生物经验(bio-experienced)的中重度斑块状银屑病患者时,显示较活性对照组具有更高的治疗持续性。此外,III 期临床研究 VOYAGE 2 试验事后分析也显示,古塞奇尤单抗在头皮斑块状银屑病患者中表现出持久的临床疗效、瘙痒缓解和生活质量改善。相关研究数据会于 2023 年美国皮肤病学会年会(AAD2023)当中公布。古塞奇尤单抗是杨森开发的一款特异性抗 IL-23 单克隆抗体,可通过与 IL-23 的 p19 亚基结合,阻断 IL-23 作用。2017 年,古塞奇尤单抗获得 FDA 批准,治疗中/重度斑块状银屑病成人患者,成为同适应症首款获批的选择性 IL-23 抑制剂。2019 年 12 月,该药在中国获批,用于适合全身性治疗的中重度斑块状银屑病成人患者。
对 IBM MarketScan 研究数据库的真实世界数据进行分析后显示(数据期间:2017 年 7 月 13 日至 2021 年 5 月 1 日),与银屑病药物司库奇尤单抗和 ixekizumab 相比,古塞奇尤单抗具有更高的持久性(即至指数治疗中止的中位时间更长):在未经生物治疗的患者中,古塞奇尤单抗队列的持续性是司库奇尤单抗队列的 2.20 倍(12 个月时)和 2.28 倍(18 个月时),是 ixekizumab 队列的 1.84 倍(12 个月时)和 1.86 倍(18 个月时)。在经具生物经验治疗患者中,古塞奇尤单抗队列的持续性是司库奇尤单抗队列的 2.00倍(12 个月时)和 2.04 倍(18 个月时),是 ixekizumab 队列的 1.76 倍(12 个月时)和 1.67 倍(18 个月时)。全球首款 PD-1/CTLA-4 双抗,上市 6 个月,销售额高达 5.46 亿元3 月 15 日,康方生物发布 2022 年业绩报告,全球首款 PD-1/CTLA-4 双抗卡度尼利单抗(AK104)销售额也同时揭晓,上市仅 6 个月,销售额就已高达 5.46 亿元。