TIGIT单抗tiragolumab接连在小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)两项临床研究中(SKYSCRAPER-02,SKYSCRAPER-01)错失主要终点,给后续研发带来阴影。2023年ASCO会议上,MORPHEUS-Liver研究结果的公布,能否给TIGIT单抗带来新的希望?
MORPHEUS-Liver,一项Ib/II期随机化临床试验,旨在评估tiragolumab联合阿替利珠单抗+贝伐珠单抗(T+A)在不可切除、局晚期或转移性肝细胞癌(uHCC)中的安全性和有效性。
基于IMbrave150结果,阿替利珠单抗+贝伐珠单抗成为目前uHCC患者的一线标准治疗。TIGIT是一种共抑制受体,和免疫检查点一样在活化的T细胞,NK细胞和Treg细胞上表达,在肝癌和其他多个癌种中均有报道。
Tiragolumab是一个人源化抗TIGIT单克隆抗体,临床前研究显示,其与其他免疫治疗药物联合后可增加抗肿瘤应答。
 MORPHEUS联合平台包含了多个Ib/II期临床试验,旨在识别各癌种中免疫联合治疗的有效性和安全性早期信号。这里公布的是针对uHCC患者的MORPHEUS-Liver(NCT04524871)结果。MORPHEUS-Liver是一个伞式试验,旨在评估多个以免疫为基础的联合治疗方案,针对既往没有接受过系统治疗的uHCC患者。队列1是评估阿替利珠单抗+贝伐珠单抗+Tiragolumab。主要研究终点是研究者评估的ORR,次要终点包括PFS和安全性。
MORPHEUS联合平台包含了多个Ib/II期临床试验,旨在识别各癌种中免疫联合治疗的有效性和安全性早期信号。这里公布的是针对uHCC患者的MORPHEUS-Liver(NCT04524871)结果。MORPHEUS-Liver是一个伞式试验,旨在评估多个以免疫为基础的联合治疗方案,针对既往没有接受过系统治疗的uHCC患者。队列1是评估阿替利珠单抗+贝伐珠单抗+Tiragolumab。主要研究终点是研究者评估的ORR,次要终点包括PFS和安全性。两组患者的基线特征方面,T+A组患者ECOG PS 0分的占比更高(72.2% vs 45.0%),入组时存在微血管侵犯(MVI)和/或肝外扩散(EHS)的比例较低(44.4%
vs 67.5%),基线时AFP水平≥400ug/L的比例更高(66.7% vs 32.5%)。
有效性结果显示,根据RECIST v1.1标准,T+A组和Tiragolumab+T+A组的ORR分别为11.1%和42.5%。根据mRECIST标准,T+A组和Tiragolumab+T+A组的ORR分别为16.7%和55.0%。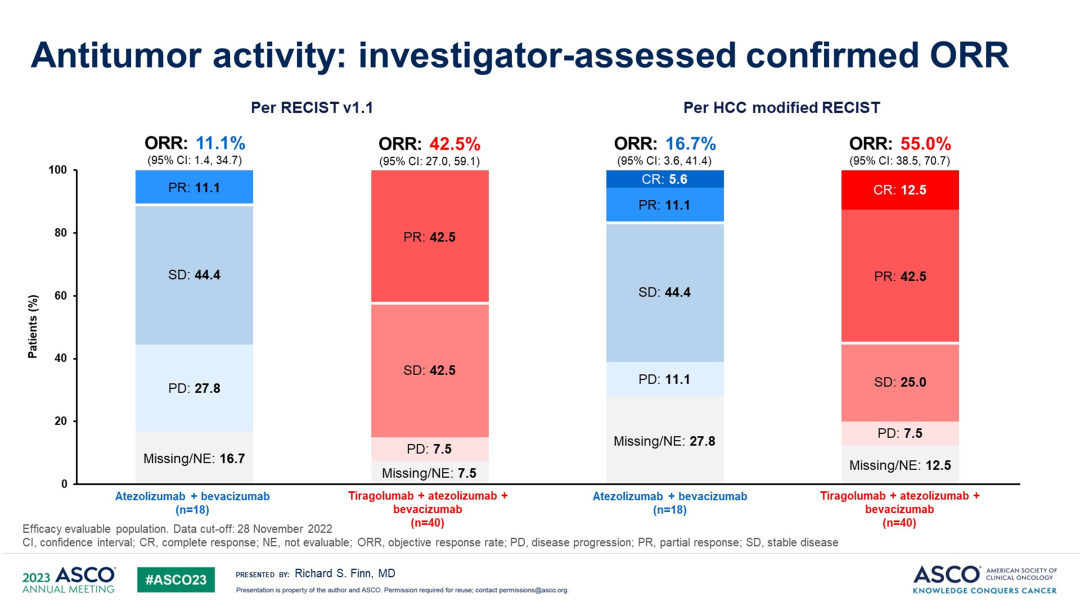
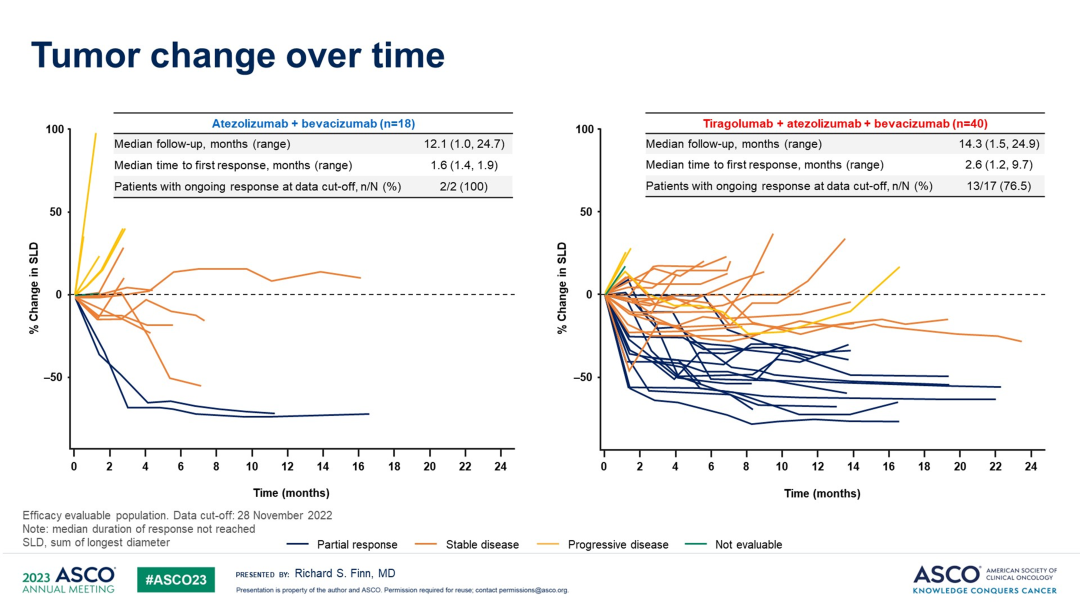
IMbrave150研究中,阿替利珠单抗+贝伐珠单抗组的中位PFS为6.9个月(5.7,8.6)。MORPHEUS-Liver研究中,阿替利珠单抗+贝伐珠单抗组和Tiragolumab+阿替利珠单抗+贝伐珠单抗组的中位PFS分别为4.2个月(1.6,7.4)和11.1个月(8.2,NE),HR=0.42(0.22,0.82)。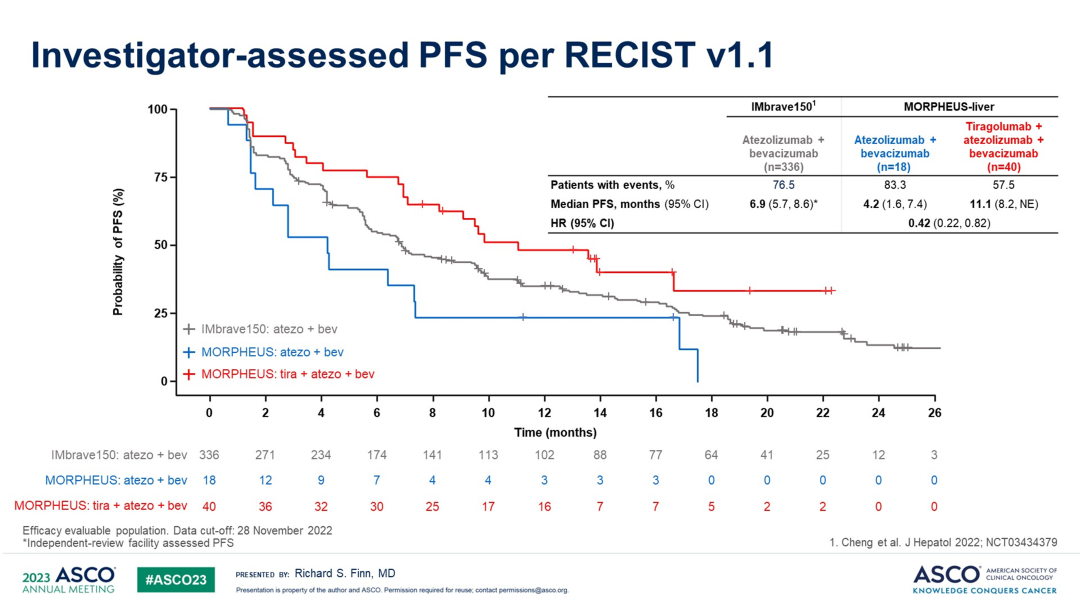
安全性方面,T+A组和Tiragolumab+T+A组治疗相关AEs的发生率分别为83.3%和97.5%,治疗相关3-4级AEs的发生率分别为33.3%和27.5%。由于治疗相关AEs导致治疗停止的发生率分别为5.6%和12.5%。
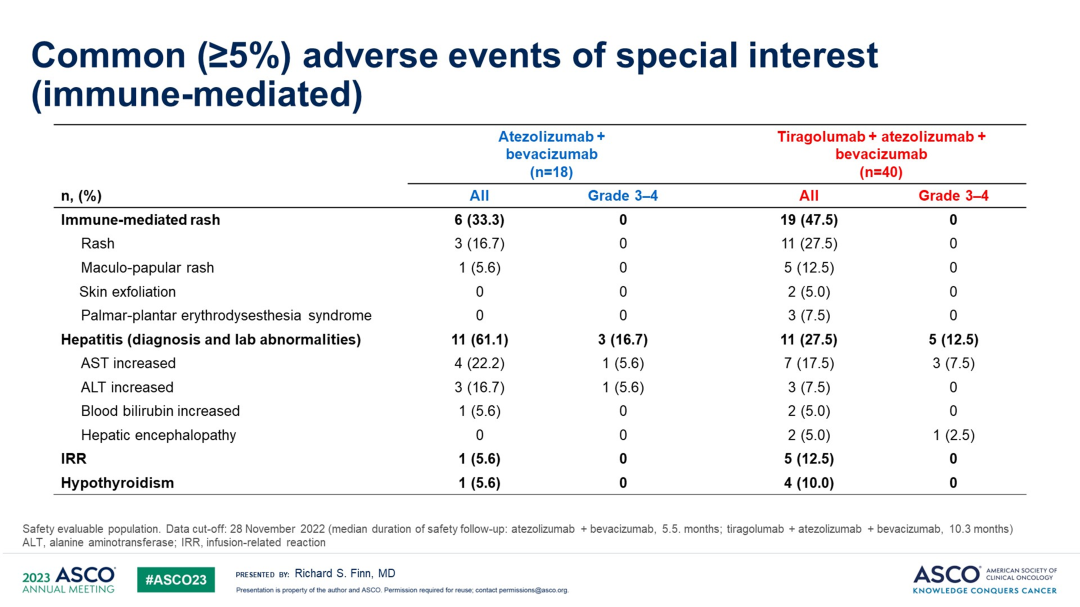
不良事件≥20%的AEs包括:瘙痒,蛋白尿,乏力,高血压,关节痛,皮疹等。与T+A组相比,Tiragolumab+T+A组的中位治疗持续时间和治疗周期数更长。
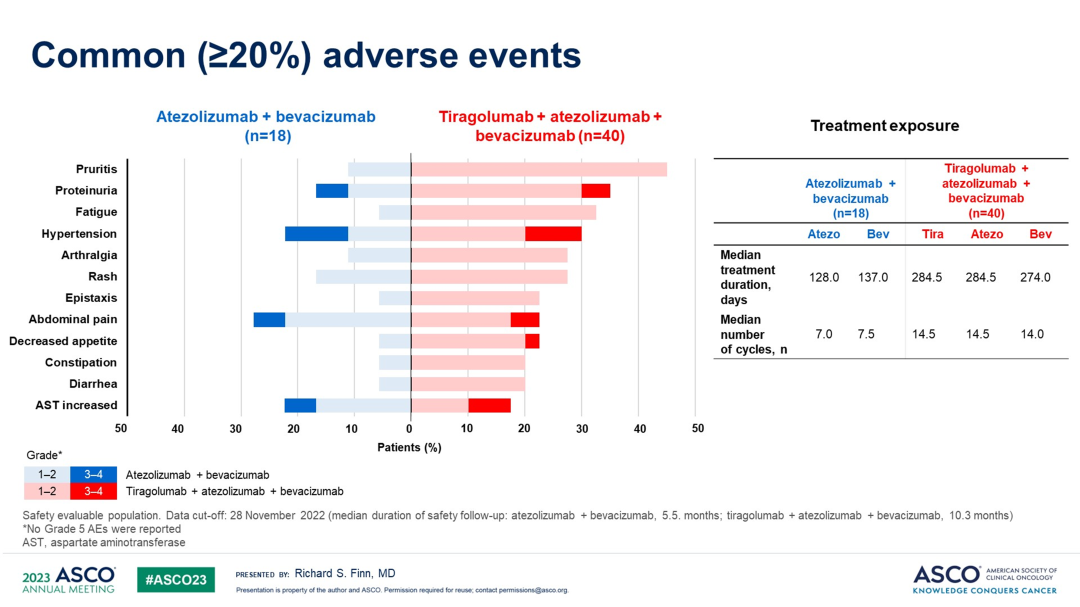
较常见的(≥5%)免疫介导AEs包括:皮疹,肝炎,甲状腺功能减退,和输注相关的反应。
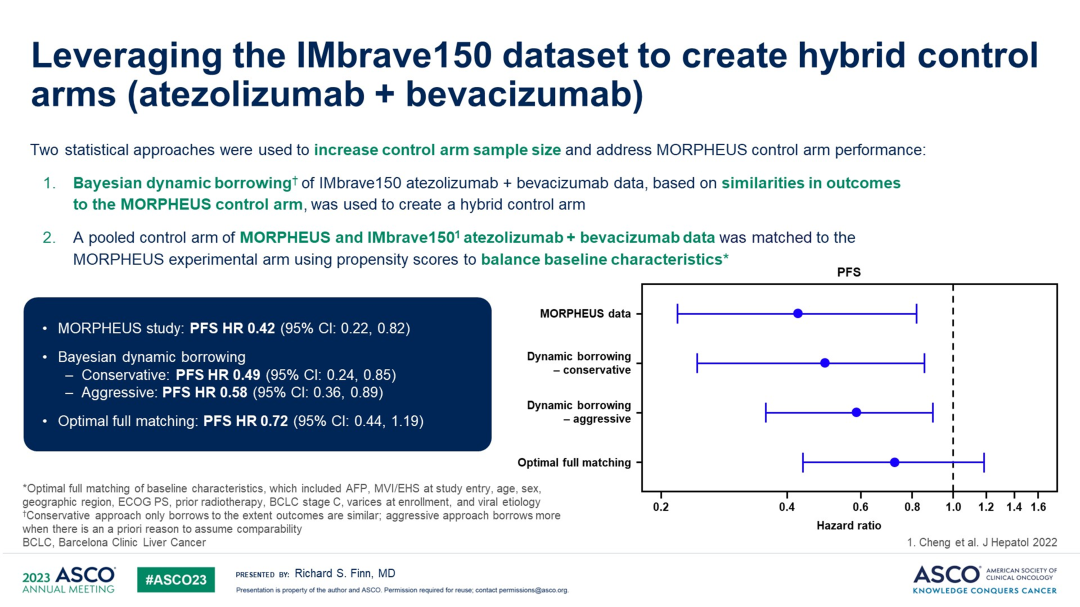
研究者还使用IMbrave150研究的数据集来创建混合对照组(hybrid control arm),并采用两种统计学方法来解决对照组样本量小和基线特征不平衡的问题。MORPHEUS-Liver研究中,HR值=0.42(0.22,0.82),通过贝叶斯动态借用(Bayesian dynamic borrowing),保守结果HR=0.49(0.24,0.85),激进结果HR=0.58(0.36,0.89),最佳全匹配(optimal full matching)PFS的HR值=0.72(0.44-1.19)。
总体来说,通过这项Ib/II期研究,相比T+A组,Tiragolumab+T+A组能改善抗肿瘤应答,但需要注意部分基线特征在两组间并不平衡。
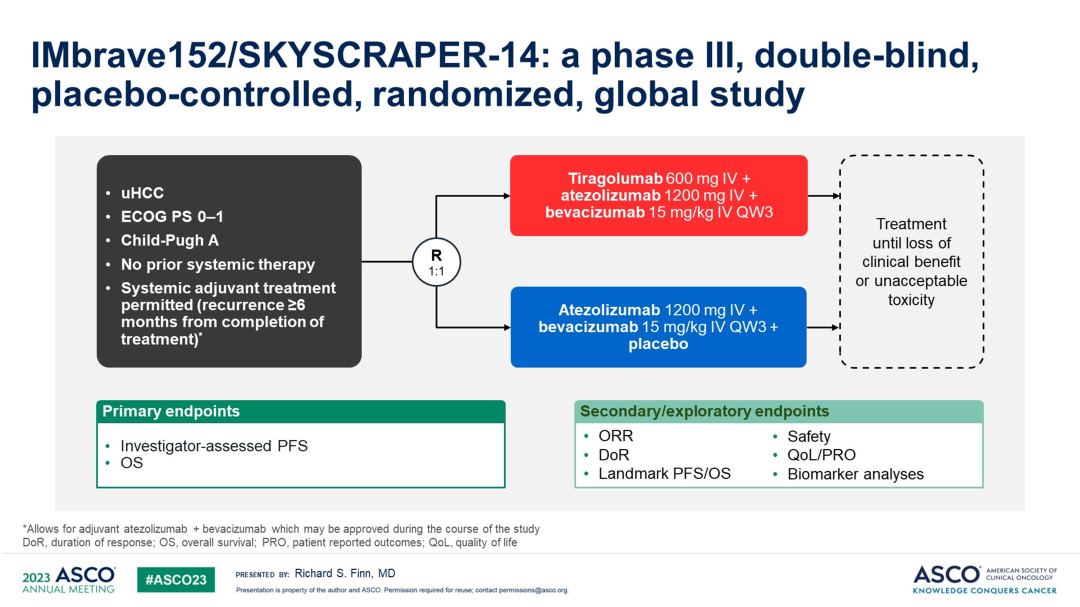
联合Tiragolumab后,并没有造成显著的治疗相关AEs的恶化,没有新的安全新信号出现。通过两项混合对照分析,提示包含Tiragolumab的治疗方案可取得获益。期待III期临床研究IMbrave152/SKYSCRAPER-14,能提供更多的数据。
补充资料:tiragolumab接连在SCLC和NSCLC两项临床研究中(SKYSCRAPER-02,SKYSCRAPER-01)错失主要终点。
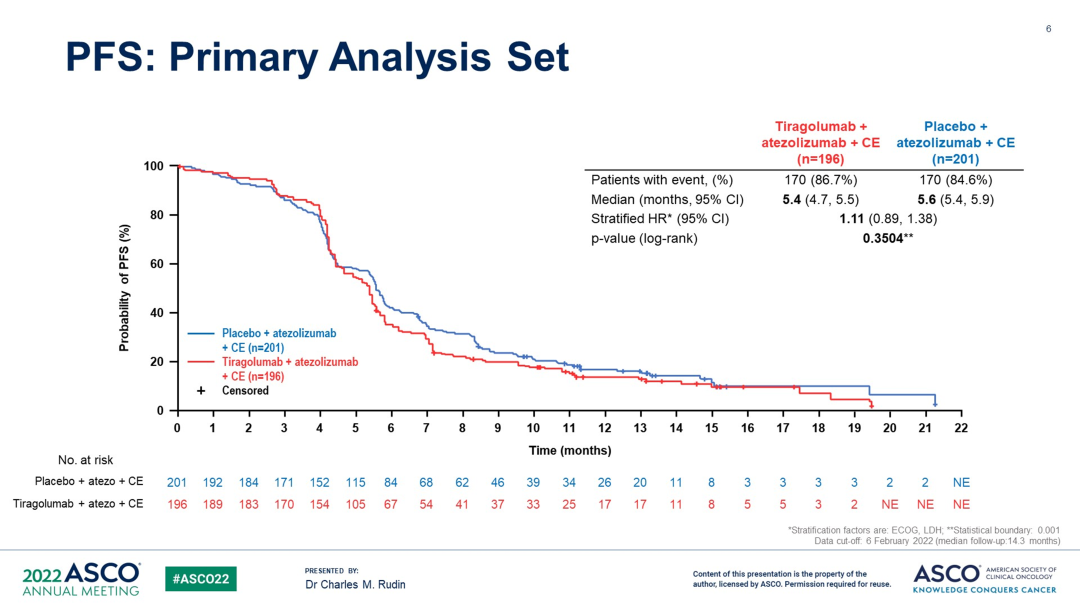
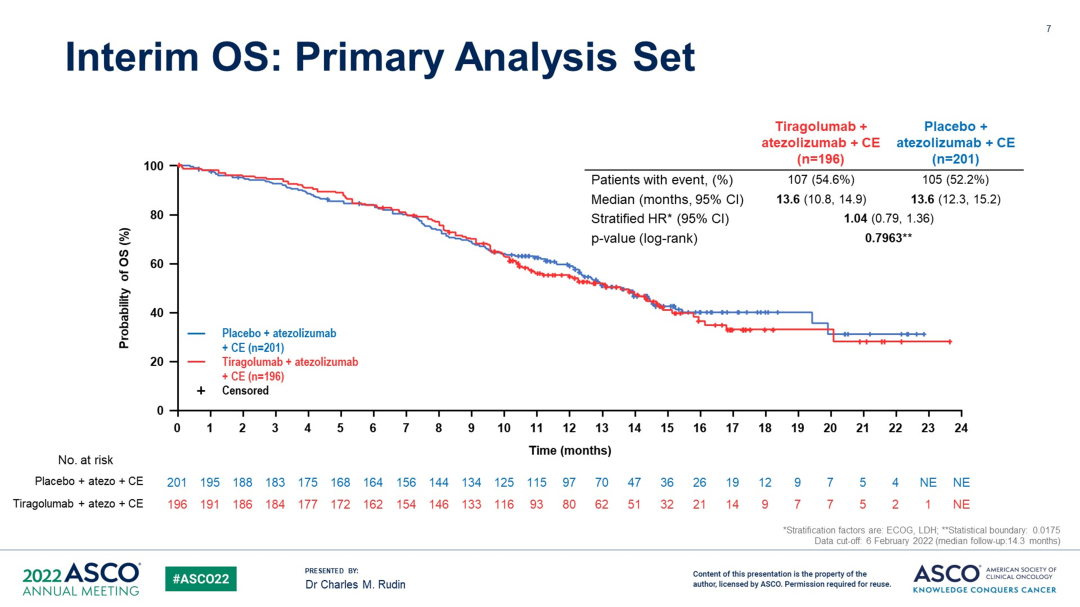
SKYSCRAPER-02是一项双盲随机、平行对照的III期临床试验,主要纳入未经治疗的广泛期SCLC患者490名,给予Tiragolumab联合阿替利珠单抗+化疗(卡铂+依托泊苷)。2022年6月首次在ASCO大会公布结果,中位随访13.9个月,Tiragolumab联合阿替利珠单抗+化疗,未能显著延长PFS和OS(主要分析集,中位PFS:5.4 vs 5.6个月,P=0.3504;中位OS:13.6 vs 13.6个月,HR=1.04,P=0.7963),两组不良反应相似。
 2022年5月11日,罗氏宣布,Tiragolumab联合PD-L1抑制剂阿替利珠单抗(Atezolizumab)vs. 阿替利珠单抗单药一线治疗PD-L1高表达局晚期或转移性NSCLC的III期SKYSCRAPER-01研究未达到PFS共同主要终点。在首次分析中,另一个共同主要终点总生存期 (OS) 尚未成熟,罗氏表示该研究将继续进行,直到下一次按指定计划的分析。
2022年5月11日,罗氏宣布,Tiragolumab联合PD-L1抑制剂阿替利珠单抗(Atezolizumab)vs. 阿替利珠单抗单药一线治疗PD-L1高表达局晚期或转移性NSCLC的III期SKYSCRAPER-01研究未达到PFS共同主要终点。在首次分析中,另一个共同主要终点总生存期 (OS) 尚未成熟,罗氏表示该研究将继续进行,直到下一次按指定计划的分析。DLL3靶向药物:小细胞肺癌治疗后浪来了?
2023 ASCO | 不止有ADAURA,值得关注的重磅临床研究TOP10(附详细背景介绍)
2023 ASCO | 结直肠癌值得关注的5项临床研究
2023 ASCO | 如何真正做到"以患者为中心",从这3项肝胆肿瘤经典研究说起......
Copyright © 2023 PHARMCUBE. All Rights Reserved.
欢迎转发分享及合理引用,引用时请在显要位置标明文章来源;如需转载,请给微信公众号后台留言或发送消息,并注明公众号名称及ID。免责申明:本微信文章中的信息仅供一般参考之用,不可直接作为决策内容,医药魔方不对任何主体因使用本文内容而导致的任何损失承担责任。