
关键词:细胞空间组织,组织成像技术,深度学习,图卷积网络
Deep learning of cell spatial organizations identifies clinically relevant insights in tissue images论文来源:Nature Communications
论文地址:https://www.nature.com/articles/s41467-023-43172-8斑图地址:https://pattern.swarma.org/paper/4c4f1e08-9879-11ee-bc79-0242ac17000e
组织成像技术的最新进展促进了生理和病理环境中各种细胞类型的可视化和识别。尽管出现了细胞-细胞相互作用研究,但仍缺乏评估单样本空间相互作用的方法。本研究介绍了 Ceograph,这是一种基于细胞空间组织的图卷积网络,旨在分析病理图像中的细胞空间组织(例如,细胞的空间分布、形态、邻近性和相互作用)。Ceograph 能准确预测细胞空间组织对患者临床结果的影响,从而识别关键的细胞空间组织特征。在口腔潜在恶性肿瘤疾病患者中,该模型突出显示了上皮基底层结构一致性降低和亲密度增加是恶性转化风险升高的驱动特征。在肺癌患者中,Ceograph 检测到肿瘤细胞核变长和上皮基质紧密度降低是对表皮生长因子受体酪氨酸激酶抑制剂不敏感的生物标志物。Ceograph 具有预测各种临床结果的潜力,能让人们更深入地了解生物过程,支持个性化治疗策略的开发。图1 a)传统图像分类(上箭头)和 Ceograph(下箭头)的流程图。b) 本研究设计的 Ceograph 结构可同时进行分类和模型解释。c) 一个节点特征(称为自节点)通过一个 CSIGC 层的详细计算过程流程图。橙色方框表示反向传播中涉及的可学习层。
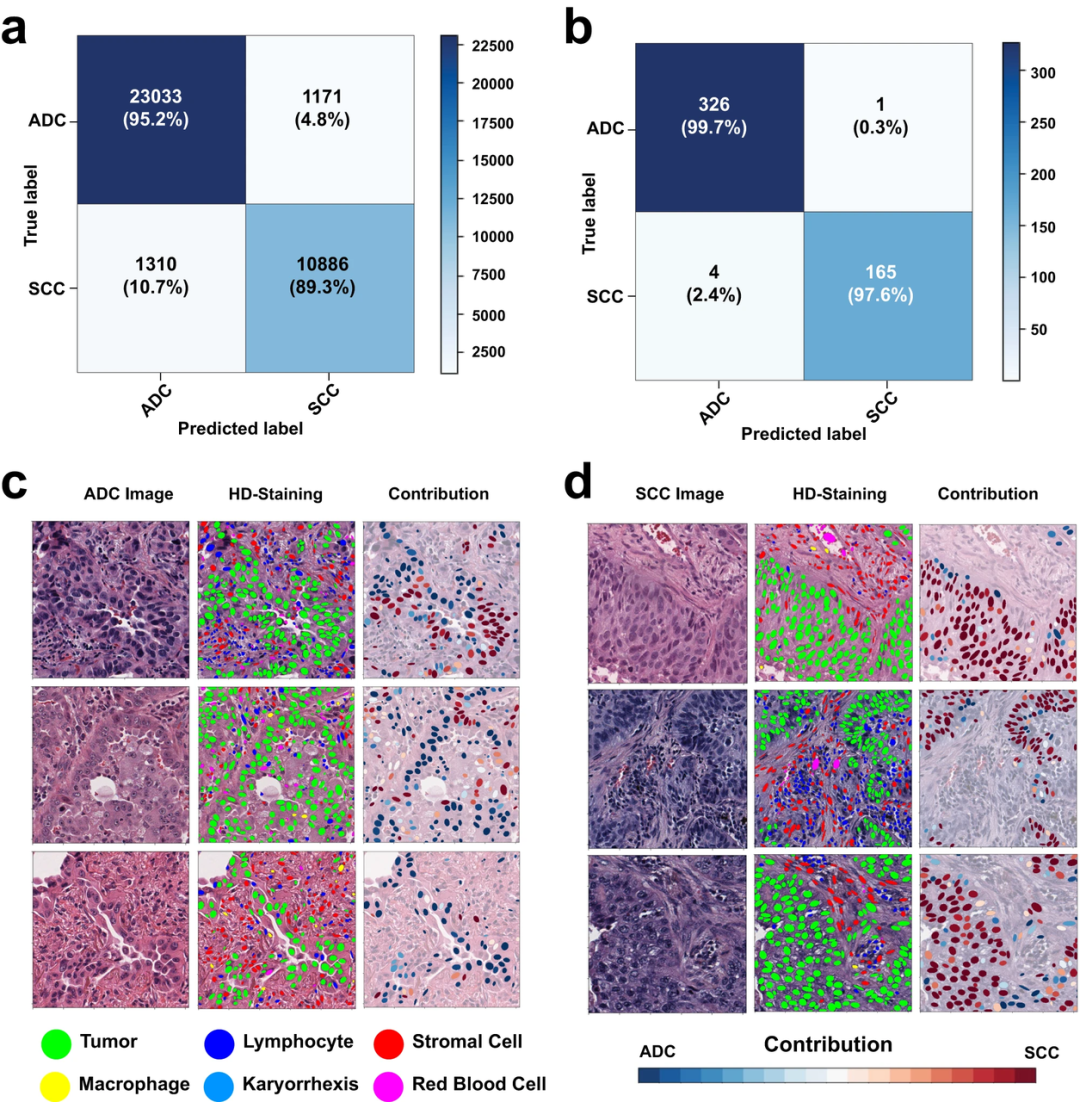
图2:Ceograph基于肺部组织切片进行细胞标注的结果展示。图像斑块级混淆矩阵(a)和幻灯片级混淆矩阵(b)。(c, d) 显示每个肿瘤核对最终组织学分类的贡献。
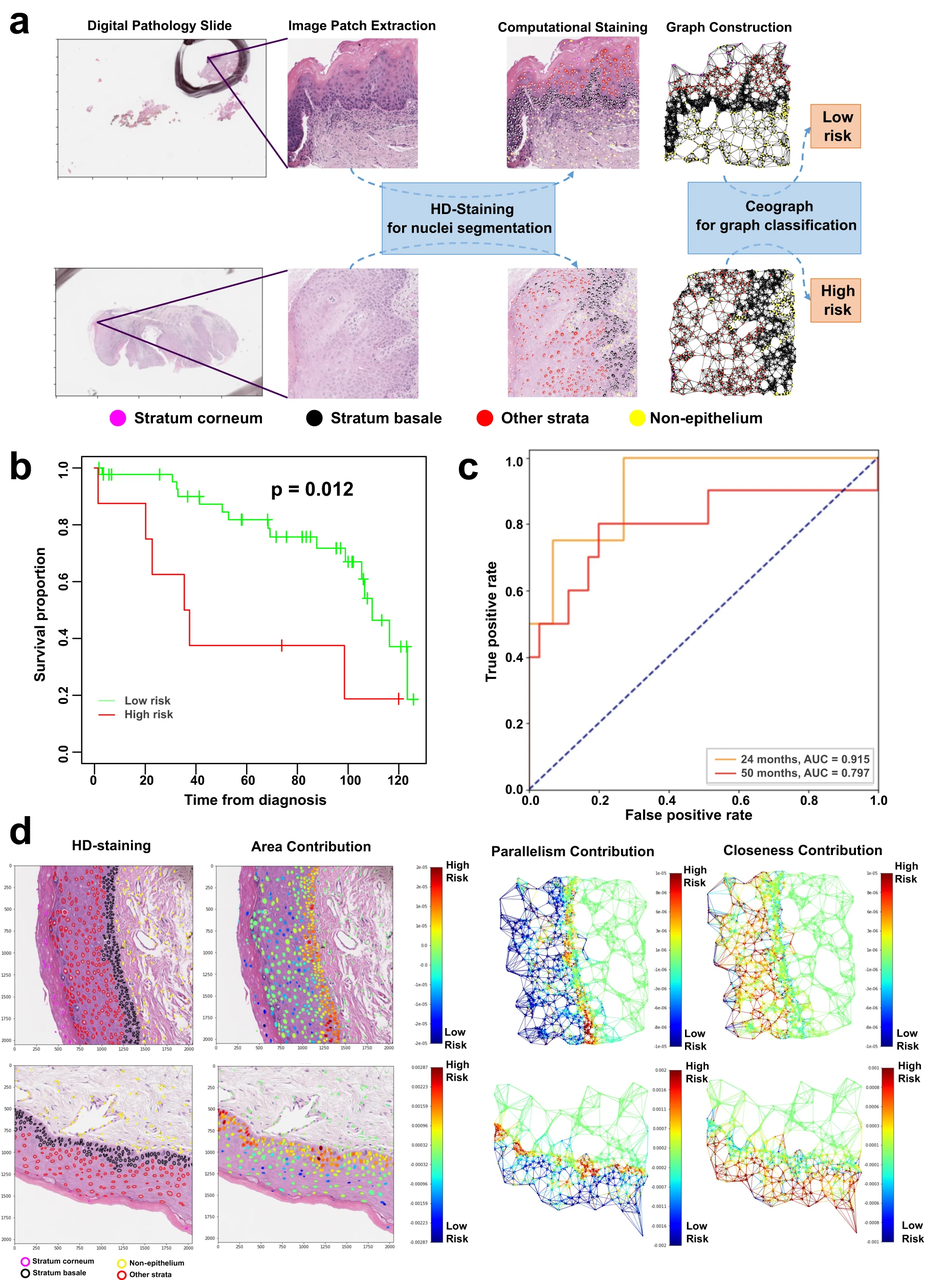
图3 Ceograph在肿瘤恶性转移风险分层预测中的预后价值。
图4:基于Ceograph预测EGFR TKI 靶向治疗的有效与否
大模型与生物医学:
AI + Science第二季读书会启动
详情请见:
大模型与生物医学:AI + Science第二季读书会启动
点击“阅读原文”,报名读书会