肿瘤免疫治疗是继手术、放疗、化疗和靶向治疗后的“第五大支柱”,其中免疫检查点抑制剂(ICI)的问世彻底改变了多种癌症的治疗格局。以PD-1/PD-L1抑制剂为代表的ICI通过阻断肿瘤细胞的“免疫逃逸”通路,重新激活T细胞抗肿瘤免疫,已在黑色素瘤、非小细胞肺癌(NSCLC)等癌种中实现长期生存获益。然而,仅20%-30%的患者对PD-1/PD-L1抑制剂响应,且部分患者初始有效后仍会发生继发性耐药。因此,探索新型免疫检查点、开发协同治疗策略成为当前研究的核心方向。
TIGIT(T cell immunoglobulin and ITIM domain)作为近年来备受关注的免疫抑制性受体,在T细胞、自然杀伤(NK)细胞等免疫细胞表面高表达,通过多重机制抑制抗肿瘤免疫应答。临床前研究显示,TIGIT与
PD-1通路存在显著协同性,联合阻断可产生“1+1>2”的抗肿瘤效果。目前,全球已有超30款TIGIT抑制剂进入临床开发阶段,其中罗氏的tiragolumab、默克的vibostolimab等药物已进入III期临床试验。本文将从作用机制、药物研发、临床应用三个维度,系统剖析TIGIT抑制剂的科学价值以及转化前景。
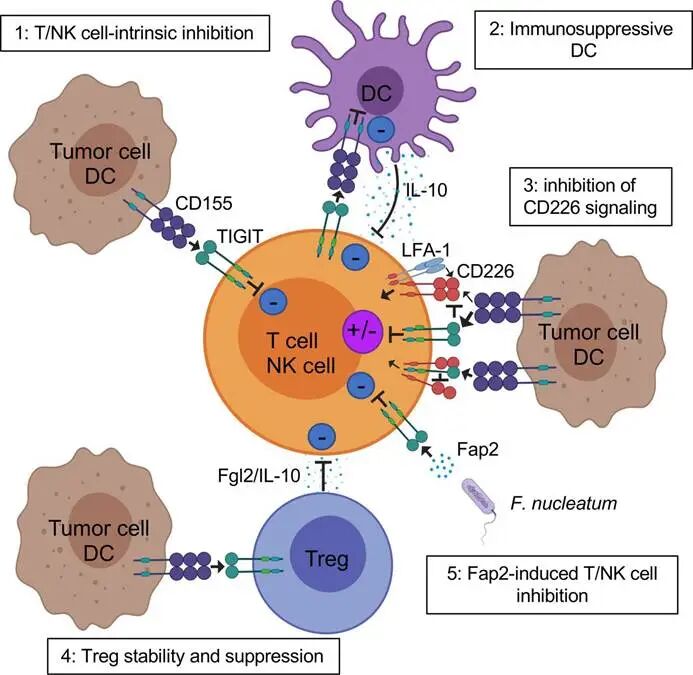
图1. TIGIT抑制肿瘤微环境(TME)T细胞的机制
(一)TIGIT抑制剂的作用机制:多维调控肿瘤免疫微环境
TIGIT属于免疫球蛋白超家族,2010年首次被鉴定为具有免疫抑制功能的受体。其结构包含胞外免疫球蛋白可变区(IgV
)、跨膜区和胞内免疫受体酪氨酸抑制基序(ITIM)及免疫受体酪氨酸转换基序(ITSM),通过识别配体传递抑制信号。深入理解其作用机制,是药物研发的理论基础。
1.1 TIGIT的表达谱与配体网络
TIGIT主要表达于活化的CD8⁺ T细胞、CD4⁺ T细胞(尤其是滤泡辅助性T细胞Tfh)、调节性T细胞(Treg)和NK细胞表面。在肿瘤微环境(TME)中,肿瘤抗原持续刺激导致T细胞耗竭,TIGIT与PD-1、TIM-3等共表达,成为耗竭T细胞的标志性分子。
TIGIT的配体包括CD155
(PVR)、CD112(PVRL2、Nectin-2)和CD113(PVRL3),其中CD155亲和力最高(Kd≈1μM)。CD155广泛表达于肿瘤细胞、树突状细胞(DC)、巨噬细胞等,其表达受IFN-γ、DNA损伤反应等调控,是肿瘤免疫逃逸的关键“桥梁”。值得注意的是,CD155同时可与共刺激受体CD226(DNAM-1)结合,TIGIT与CD226
竞争性结合CD155,形成“抑制-刺激”平衡:正常状态下,CD226介导T细胞/NK细胞活化;肿瘤状态下,TIGIT高表达“抢占”CD155,抑制免疫应答。
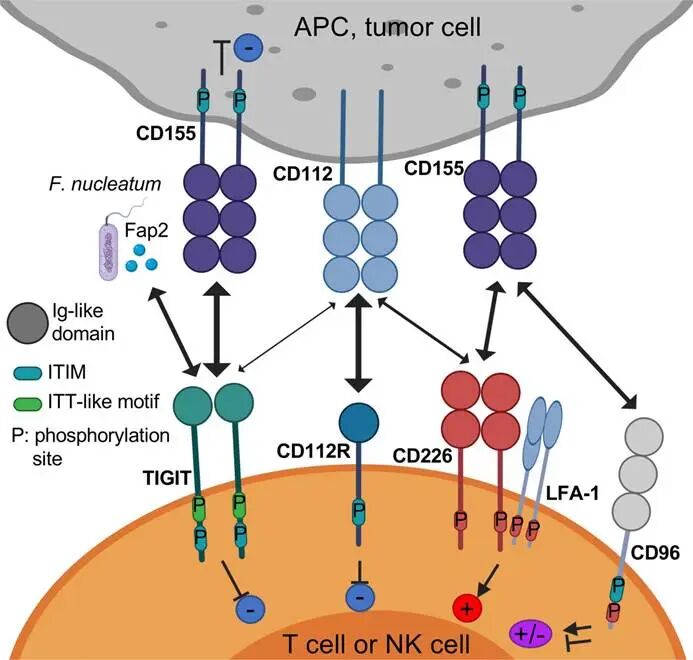
图2. TIGIT轴和配体结构示意图
1.2 信号通路:直接抑制免疫细胞功能
TIGIT通过胞内ITIM/ITSM招募磷酸酶(如SHP-1/2、SHIP1),阻断下游信号通路,直接抑制免疫细胞活性:
l
T细胞:抑制TCR/CD28共刺激信号,减少IL-2、IFN-γ、TNF-α等细胞因子分泌,阻断细胞增殖和细胞毒性功能;
l NK细胞:抑制NKG2D、CD16等活化受体信号,降低颗粒酶B、穿孔素释放,削弱对肿瘤细胞的直接杀伤;
l Treg:增强Treg的抑制活性,促进IL-10、TGF-β分泌,进一步抑制效应T细胞功能。
1.3 调控抗原呈递与免疫微环境
除直接抑制免疫细胞外,TIGIT还通过影响抗原呈递细胞(
APC)重塑免疫微环境:DC表面的TIGIT与CD155结合后,可抑制IL-12分泌,降低共刺激分子CD80/CD86表达,导致T细胞活化不足。同时,TIGIT⁺ Treg通过CD155相互作用,促进DC转化为耐受性表型,形成“免疫抑制闭环”。
1.4 与PD-1通路的协同性
TIGIT与PD-1在耗竭T细胞中共表达,且信号通路存在互补性:PD-1主要抑制TCR近端信号(如PI3K-Akt
),TIGIT则同时影响TCR和共刺激信号(如CD28)。临床前模型显示,联合阻断TIGIT和PD-1可更显著地恢复T细胞功能,增加肿瘤浸润淋巴细胞(TIL)数量,优于单药治疗。这种协同性为联合治疗提供了理论依据。
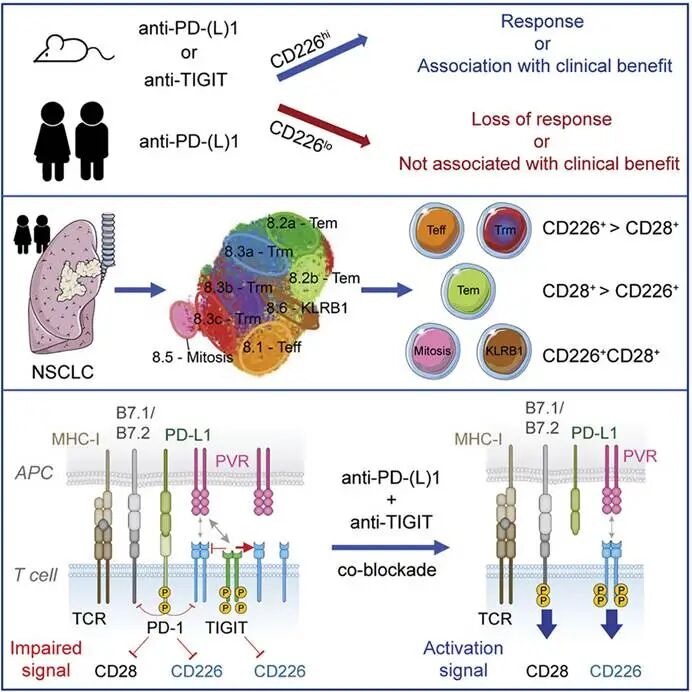
图3. TIGIT与PD-1通路机制趋同协同阻断优化抗肿瘤CD8+ T细胞应答机制示意图
(二)TIGIT抑制剂的药物研发
基于明确的生物学机制,TIGIT抑制剂的研发在过去5年迎来爆发。目前,药物类型主要包括单克隆抗体(单抗)、双特异性抗体(双抗)和融合蛋白,靶点覆盖TIGIT及其配体CD155
。
2.1 研发历程
2016年,Nature发表论文首次证实TIGIT⁺ Treg是肿瘤免疫抑制的关键群体,阻断TIGIT可抑制肿瘤生长,推动TIGIT从“基础分子”走向“药物靶点”。2018年,罗氏启动tiragolumab的首项临床试验(CITYSCAPE研究),标志着TIGIT抑制剂进入临床开发阶段。截至2024年,全球已有30余款TIGIT相关药物进入临床,其中10款进入III期,适应症覆盖
NSCLC、小细胞肺癌(SCLC)、结直肠癌、肝癌等高发癌种。
2.2 代表性药物及研发进展
(1)单克隆抗体:主流研发方向
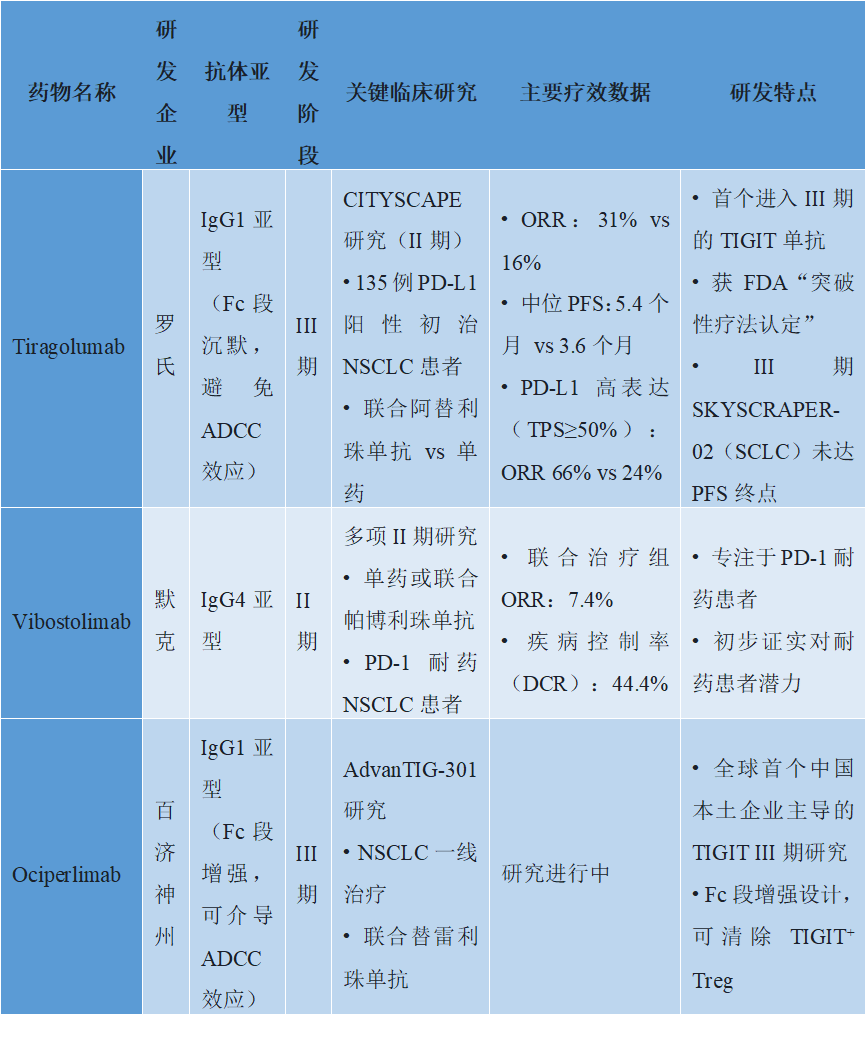
l Tiragolumab(罗氏):首个进入III期的TIGIT单抗,IgG1亚型(Fc段沉默,避免ADCC效应)。关键II期CITYSCAPE研究纳入135例PD-L1阳性(TPS≥1%)初治NSCLC患者,结果显示,tiragolumab联合阿替利珠单抗(PD-L1
抑制剂)vs 阿替利珠单抗单药,客观缓解率(ORR)分别为31% vs 16%,中位无进展生存期(PFS)为5.4个月 vs 3.6个月,PD-L1高表达(TPS≥50%)患者获益更显著(ORR 66% vs 24%)。基于此数据,FDA授予其“突破性疗法”认定,但III期SKYSCRAPER-02研究(SCLC一线治疗)未达PFS终点,提示疗效存在癌种差异。
l Vibostolimab(默克):IgG4亚型,单药或联合帕博利珠单抗(PD-1抑制剂)开展多项研究。II
期临床试验显示,在PD-1耐药NSCLC患者中,联合治疗组ORR为7.4%,疾病控制率(DCR)为44.4%,初步证实对耐药患者的潜力。
l Ociperlimab(百济神州):IgG1亚型,Fc段增强(可介导ADCC效应,清除TIGIT⁺ Treg),与替雷利珠单抗(PD-1抑制剂)联合的III期AdvanTIG-301研究(NSCLC一线治疗)正在进行中,是全球首个中国本土企业主导的TIGIT III期研究。
表1. TIGIT单克隆抗体主流研发方向及关键临床数据
(2)双特异性抗体:协同阻断的创新策略
为增强疗效,部分企业开发“TIGIT×PD-1/PD-L1”双抗,如康方生物的AK129(TIGIT×PD-1)、信达生物的IBI321(TIGIT×PD-L1)。临床前研究显示,双抗可同时阻断两个通路,减少给药频次,且通过靶向递送降低毒性。目前,AK129的I期研究显示,在晚期实体瘤患者中,ORR达18.2%,安全性可控。
(3)融合蛋白:靶向配体的新思路
除阻断TIGIT外,靶向配体CD155的融合蛋白(如AstraZeneca的MEDI9447)也在开发中。这类药物通过结合CD155
,同时阻断TIGIT和CD96(另一免疫抑制受体)的抑制信号,且可激活CD226通路,理论上具有更广的免疫激活效应。
2.3 研发挑战与应对策略
尽管进展迅速,TIGIT抑制剂研发仍面临三大挑战:
l 单药疗效有限:临床前模型显示,TIGIT单药抗肿瘤活性较弱,需联合PD-1/PD-L1抑制剂或化疗;
l 疗效异质性:不同癌种、PD-L1表达水平、TME特征(如TIL浸润程度)显著影响疗效,需精准筛选获益人群;
l 安全性风险:联合治疗可能增加免疫相关不良事件(irAEs),如肺炎、结肠炎,需优化剂量与给药方案。
针对上述挑战,当前研发策略聚焦于:①联合治疗(如PD-1抑制剂
+化疗+抗血管生成药物);②生物标志物开发(如TIGIT⁺ TIL比例、CD155表达水平);③结构优化(如Fc段工程化增强ADCC效应)。
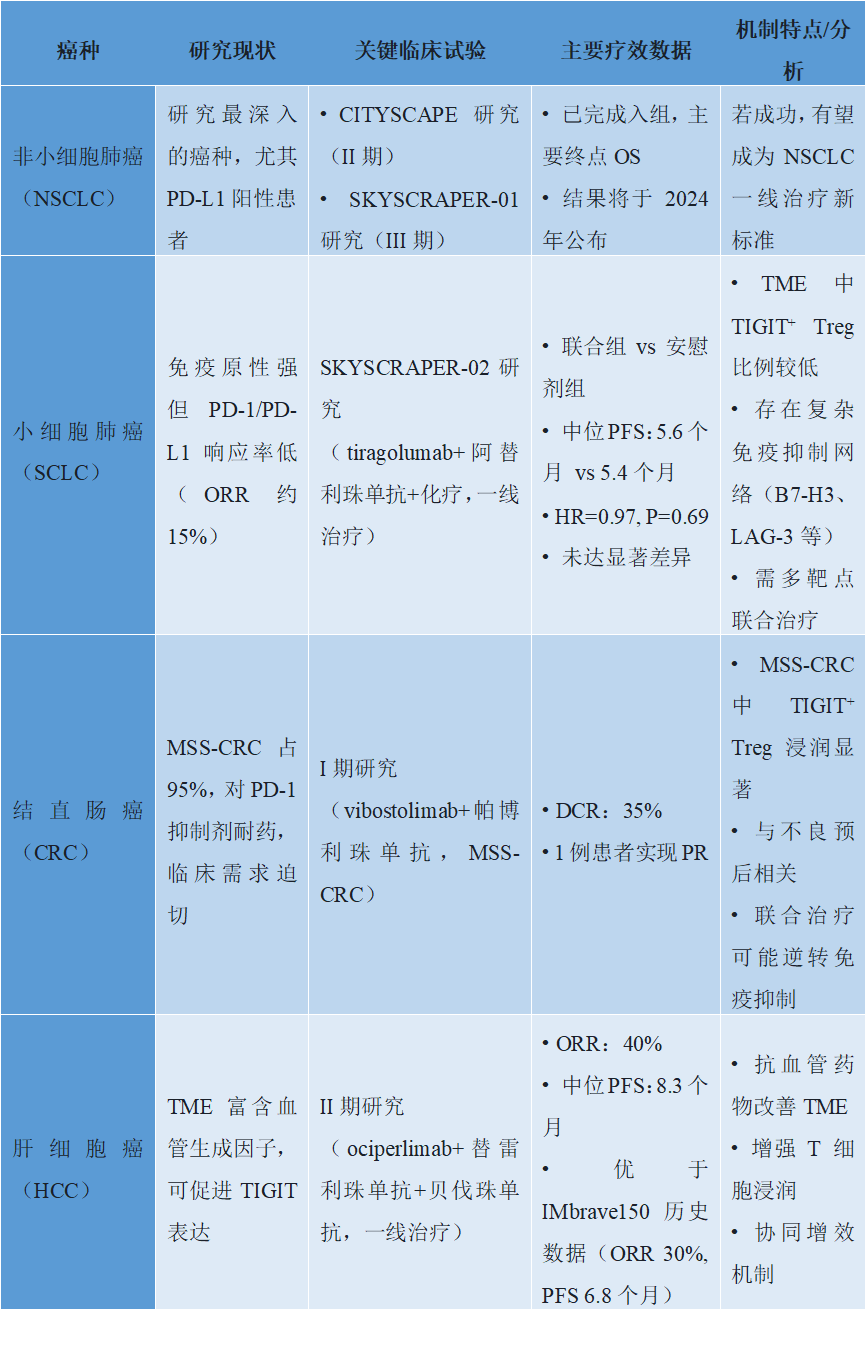
(三)TIGAT抑制剂的临床应用:从NSCLC到泛癌种的探索
TIGIT抑制剂的临床应用始于NSCLC,逐步拓展至SCLC、结直肠癌、肝癌等领域。当前,其核心价值在于解决PD-1/PD-L1抑制剂的耐药问题,并提升一线治疗疗效。
3.1 关键癌种的临床试验数据
(1)非小细胞肺癌(NSCLC)
NSCLC是TIGIT抑制剂研究最深入的癌种,尤其是PD-L1阳性患者。除CITYSCAPE研究外,tiragolumab联合阿替利珠单抗的III期SKYSCRAPER-01研究(PD-L1 TPS≥50%初治NSCLC)已完成入组,主要终点为总生存期(OS),结果将于2024年公布。若研究成功,TIGIT抑制剂有望成为NSCLC一线治疗新标准。
(2)小细胞肺癌(SCLC)
SCLC免疫原性强,但对PD-1/PD-L1抑制剂响应率低(ORR约15%)。
SKYSCRAPER-02研究评估tiragolumab联合阿替利珠单抗+化疗(一线治疗),结果显示,联合组 vs 安慰剂组中位PFS为5.6个月 vs 5.4个月(HR=0.97,P=0.69),未达显著差异。分析认为,SCLC的TME中TIGIT⁺ Treg比例较低,且存在复杂免疫抑制网络(如B7-H3、LAG-3),需多靶点联合。
(3)结直肠癌(CRC)
MSS-CRC占CRC的95%,对
PD-1抑制剂耐药,临床需求迫切。临床前研究显示,MSS-CRC中TIGIT⁺ Treg浸润显著,与不良预后相关。I期研究显示,vibostolimab联合帕博利珠单抗在MSS-CRC患者中DCR为35%,其中1例患者实现部分缓解(PR),提示联合治疗可能逆转免疫抑制。
(4)肝细胞癌(HCC)
HCC的TME富含血管生成因子(如VEGF),可促进TIGIT表达。II期研究显示,ociperlimab联合替雷利珠单抗+
贝伐珠单抗(抗血管生成药)一线治疗HCC,ORR达40%,中位PFS为8.3个月,优于历史数据(IMbrave150研究:ORR 30%,PFS 6.8个月),机制可能与抗血管药物改善TME、增强T细胞浸润有关。
表2. TIGIT抑制剂关键癌种临床试验数据
3.2 联合治疗策略
基于TIGIT与PD-1的协同性,“TIGIT抑制剂+PD-1/PD-L1抑制剂
”成为基础联合方案。为进一步提升疗效,研究者探索了“三联”甚至“四联”策略:
l 联合化疗:化疗可诱导肿瘤细胞免疫原性死亡,释放抗原,增强TIGIT抑制剂疗效。Skyscraper-06临床研究显示,tiragolumab+阿替利珠单抗+化疗一线治疗NSCLC,ORR达50%,中位PFS为8.3个月,但与帕博利珠单抗+化疗组相比,tiragolumab+阿替利珠单抗+化疗未能改善晚期非鳞状NSCLC
患者的PFS和OS。然而,在The Lancet Oncology发表的一项随机、双盲、安慰剂对照的II期临床试验表明,tiagolumab联合阿替利珠单抗治疗NSCLC安全有效,在ORR和PFS方面较对照组有所改善,且这一组合疗法的耐受性良好,总体上安全性与阿替利珠单抗单药类似。
l 联合抗血管生成药物:如前述HCC研究,抗血管药物可降低TME缺氧,减少Treg浸润,协同TIGIT抑制剂;
l 联合放疗:放疗促进肿瘤抗原释放,上调PD-L1和TIGIT表达,为联合治疗提供“窗口期
”。I期研究显示,vibostolimab+帕博利珠单抗+放疗在晚期NSCLC患者中ORR为42%,安全性可控。
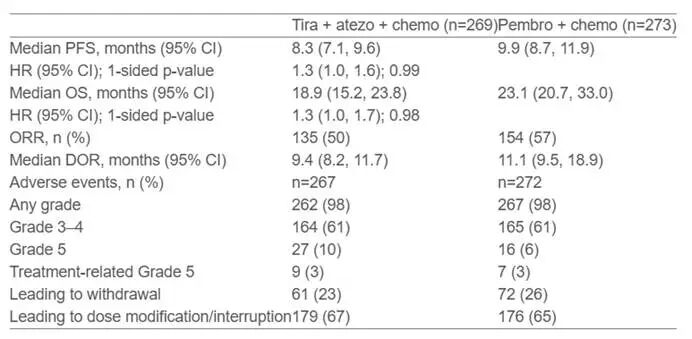
图4. SKYSCRAPER-06临床研究结果
3.3 生物标志物与疗效预测
为筛选获益人群,生物标志物研究是当前热点。潜在标志物包括:
l PD-L1表达水平:CITYSCAPE研究显示,PD-L1 TPS≥50%患者获益更显著,提示PD-L1可作为基础筛选指标;
l TIGIT⁺ TIL比例:肿瘤组织中TIGIT⁺ CD8⁺ T
细胞比例越高,TIGIT抑制剂疗效越好,可能与耗竭T细胞更易被“再激活”有关;
l CD155表达水平:肿瘤细胞或APC表面CD155高表达,可能预测TIGIT阻断敏感性,但需大样本验证;
l 肠道菌群:研究发现,特定菌群(如Akkermansia muciniphila)可增强TIGIT抑制剂疗效,机制可能与调节全身免疫应答有关。
目前,尚无单一标志物可精准预测疗效,但多组学联合(如转录组+免疫组化+微生物组)是未来研究方向。
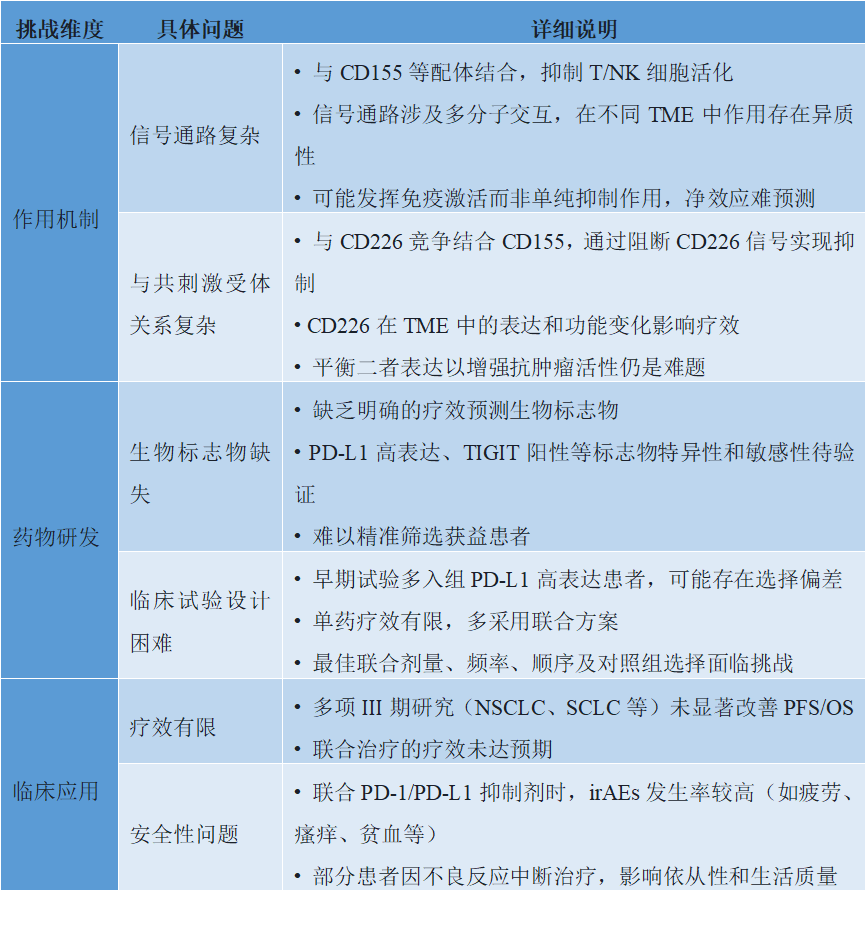
(四)面临的挑战
TIGIT抑制剂研发面临多重挑战:在作用机制上,其信号通路复杂且在不同肿瘤微环境中存在异质性,与共刺激受体
CD226的竞争关系也增加了疗效预测的难度;在药物研发上,缺乏明确的生物标志物导致患者筛选困难,而临床试验设计中的潜在偏差和联合方案的复杂性也带来了不确定性;在临床应用上,尽管早期研究显示潜力,但多项III期研究未能显著改善生存期,疗效未达预期,同时与PD-1/PD-L1抑制剂联用导致的免疫相关不良事件也限制了其应用。
表3. TIGIT抑制剂研发面临的挑战
(五)总结
综上所述,TIGIT抑制剂作为肿瘤免疫治疗的新兴靶点,通过多重机制逆转免疫抑制,与PD-1/PD-L1抑制剂协同增效,为克服耐药、提升疗效提供了新思路。当前,其在NSCLC一线治疗中展现出显著潜力,III期研究结果将决定其能否成为临床新标准;在SCLC、MSS-CRC等难治性癌种中,联合治疗策略仍在探索,需进一步优化方案。然而,TIGIT抑制剂仍面临单药疗效有限、疗效异质性、生物标志物缺乏等挑战。未来研究需聚焦:①深入解析TIGIT在不同癌种TME中的作用机制;②开发新型联合策略(如双抗、多靶点联合);
③建立精准的生物标志物体系,实现个体化治疗。随着临床研究的推进和技术的迭代,TIGIT抑制剂有望从“潜力新星”成长为“临床主力”,为更多肿瘤患者带来长期生存希望。肿瘤免疫治疗的“下一站”,或许正由TIGIT开启!
参考文献:
[1] Cho BC, Abreu DR, Hussein M, Cobo M, Patel AJ, Secen N, Lee KH, Massuti B, Hiret S, Yang JCH, Barlesi F, Lee DH, Ares LP, Hsieh RW, Patil NS, Twomey P, Yang X, Meng R, Johnson ML. Tiragolumab plus atezolizumab versus placebo plus atezolizumab as a first-line treatment for PD-L1-selected non-small-cell lung cancer (CITYSCAPE): primary and follow-up analyses of a randomised, double-blind, phase 2 study. Lancet Oncol. 2022 Jun;23(6):781-792. doi: 10.1016/S1470-2045(22)00226-1.
[2] Chauvin JM, Zarour HM. TIGIT in cancer immunotherapy. J Immunother Cancer. 2020 Sep;8(2):e000957. doi: 10.1136/jitc-2020-000957.
[3] Banta KL, Xu X, Chitre AS, Au-Yeung A, Takahashi C, O'Gorman WE, Wu TD, Mittman S, Cubas R, Comps-Agrar L, Fulzele A, Bennett EJ, Grogan JL, Hui E, Chiang EY, Mellman I. Mechanistic convergence of the TIGIT and PD-1 inhibitory pathways necessitates co-blockade to optimize anti-tumor CD8+ T cell responses. Immunity. 2022 Mar 8;55(3):512-526.e9. doi: 10.1016/j.immuni.2022.02.005.
作者介绍:Ketty,主要从事药物研发和科普,制药行业政策和发展研究工作。