今天要解读的这篇发表于《Advanced Science》的佳作,来自中国农科院赵桂萍研究员和丹麦奥胡斯大学房灵昭教授的联合团队,正是打通物种壁垒、连接基础研究与育种/医学实践的典范。研究者们别出心裁地构建了一个多代鸡模型,通过巧妙的“同质死亡率”交配设计,成功分离出高、低死亡风险群体。随后,他们整合了全基因组重测序、血清代谢组、转录组(鸡GTEx)和肠道微生物组,开展了一场系统性的“侦探工作”:
首先,他们揭示了死亡率背后深刻的 “免疫-生长”代谢权衡——高死亡率个体以生长发育为代价,换取了更强的炎症应答。
进而,通过mGWAS绘制了超过4.5万个代谢物QTL图谱,发现肝脏是调控这一代谢重塑的核心枢纽。
最关键的是,他们融合LASSO回归与WGCNA网络分析,从上千个代谢物中提炼出一个仅含16个代谢物的强悍标签,不仅在鸡群内部验证有效,更在人类极端长寿队列中显示出卓越的跨物种预测能力!
最后,功能实验深入阐释了丁酸盐的宿主-菌群互作机制,以及L-半胱氨酸“双管齐下”调控抗氧化通路的新颖模式。
这项研究远不止于讲述一个“鸡的故事”,它为我们提供了一个进化保守的“免疫-代谢”框架。无论你是研究人类复杂疾病、家畜育种,还是对多组学整合方法本身感兴趣,这篇文章在理论、方法、资源上都提供了极具价值的见解。
2025 - Integrative Omics Defines Metabolic Biomarkers and Genetic Regulatory Mechanisms of Mortality Risk - Advanced Science
本研究通过多组学整合+机器学习+实验验证的系统性策略,揭示了鸡死亡风险的代谢与遗传基础,并成功将其拓展至人类疾病模型,为精准育种与人类代谢疾病研究提供了新的生物标志物与机制见解。
一、研究框架
本研究构建了一个多代鸡模型,通过同质死亡率交配设计,系统解析死亡风险的遗传与代谢基础。研究框架包括:
实验模型与群体分层:
多组学数据整合:
血清代谢组(非靶向LC-MS/MS)
全基因组重测序(GWAS)
转录组(RNA-seq)与鸡GTEx数据
微生物组(16S rRNA)
分析流程:
二、主要内容
死亡率驱动的代谢重塑:
遗传调控机制解析:
生物标志物筛选与验证:
跨物种保守性与机制验证:
三、重要发现
代谢权衡是死亡风险的核心机制:
肝脏是代谢调控的中枢器官:
16代谢物标志物具跨物种预测价值:
宿主基因-微生物互作调控代谢表型:
L-半胱氨酸具双重抗氧化机制:
四、所使用的方法
-------------------------------------------
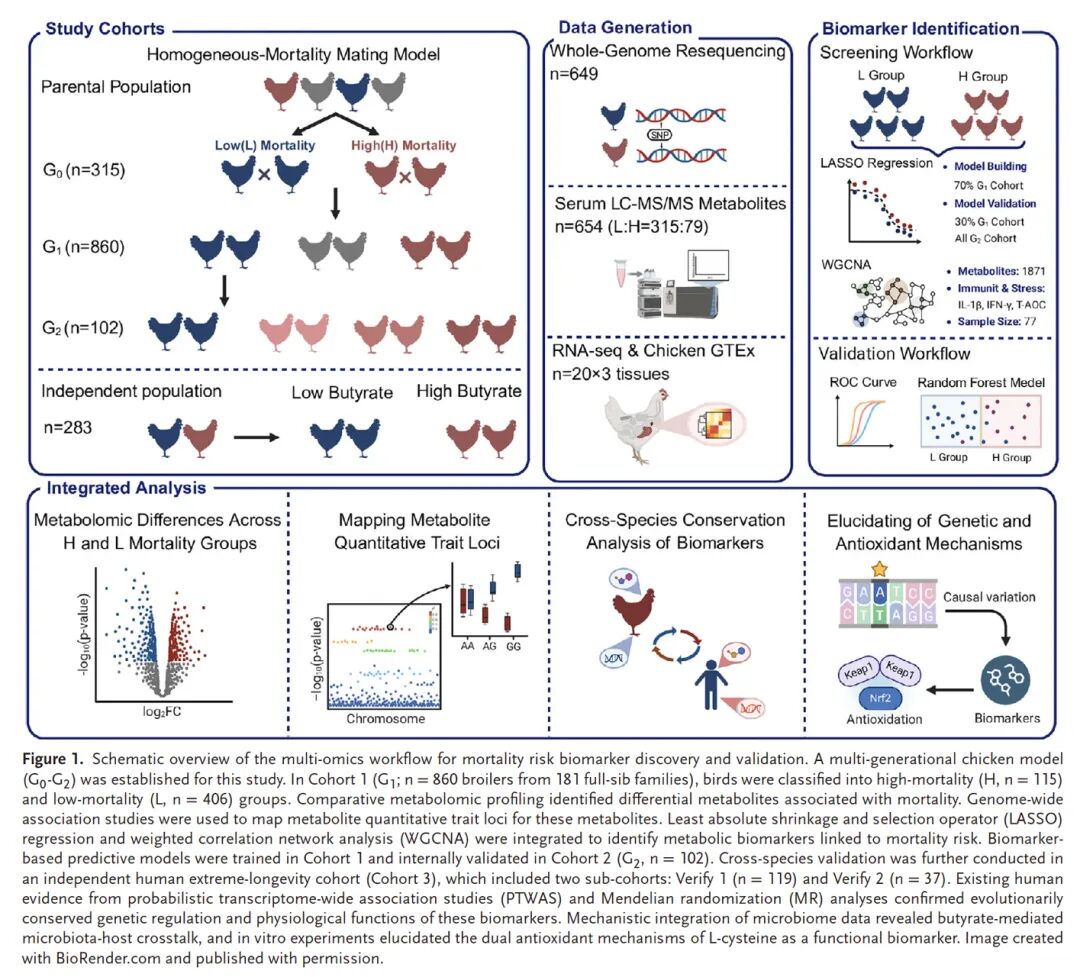 Figure 1. 多组学整合研究框架解析鸡死亡率风险的生物标志物
Figure 1. 多组学整合研究框架解析鸡死亡率风险的生物标志物
本研究采用多代鸡模型(G0-G2),通过死亡率驱动的同质交配设计,构建了高死亡率(H)与低死亡率(L)对比群体(Cohort 1)。整合血清代谢组学与全基因组关联分析(mGWAS),鉴定死亡率相关差异代谢物及其代谢数量性状位点(mQTL)。进一步融合LASSO回归与加权基因共表达网络分析(WGCNA),筛选核心生物标志物,并在内部验证队列(Cohort 2)与人类极端长寿队列(Cohort 3)中进行跨物种验证。通过孟德尔随机化(MR)、微生物组数据与体外实验,最终揭示了丁酸盐介导的微生物-宿主互作及L-半胱氨酸的双重抗氧化机制。
Figure 2. 死亡率驱动的人工选择重塑血清代谢网络并介导资源再分配
A) Cohort 1中H与L组间死亡率存在极显著差异。B) 细胞因子IL-1β与IFN-γ对死亡率风险展现出高诊断效能(ROC曲线)。C) L组在生长后期表现出显著的体重优势,揭示了免疫与生长之间的权衡。D-E) 代谢物的分类组成、变异系数(CV)与模型贡献度(VIP)分布。F-H) 差异积累代谢物(DAMs)在超级类别中的分布、OPLS-DA得分图及火山图,显示H与L组间显著的代谢分离。I) DAMs与炎症指标(IL-1β, IFN-γ)及总抗氧化能力(T-AOC)的相关性分析,揭示了促炎症代谢组特征。
Figure 3. 以肝脏为中心的多层级调控架构介导了死亡率选择下的代谢渠化
A) 与150个DAMs显著关联的mQTL在全基因组范围内的分布圈图。B) 不同代谢物超级类别的遗传力(h²)分布。C) mQTL与鸡复杂生产性状QTL的重叠数量,揭示了其多效性。D) 各代谢物GWAS的基因组膨胀因子(λ)。E) 比较仅含mQTL的简化模型与同时包含mQTL和死亡率分组的完整模型,评估生理状态对代谢变异的独立贡献。F) mQTL与鸡GTEx项目中各类分子QTL(molQTL) 的重叠分析,显示其在肝脏组织中高度富集,尤其是在cis-exQTL中。
Figure 4. 整合机器学习与网络分析鉴定死亡率风险的预测性生物标志物
A) LASSO回归筛选出的前20个关键代谢物的比值比(OR)分布。B-D) 基于92个LASSO候选代谢物构建的随机森林(RF)模型在训练集(Cohort 1)中表现出色,但在独立验证集(Cohort 2)中性能下降,表明存在过拟合。E) 将92个代谢物与WGCNA筛选的炎症相关模块(棕色模块)取交集后,得到的16个核心生物标志物所构建的RF模型,在Cohort 1中保持了高预测精度。F) 代谢物模块与免疫/抗氧化表型的相关性热图。G) RF模型中对16个生物标志物的变量重要性排序。
Figure 5. 跨物种保守的急性死亡率生物标志物呈现差异化的免疫-代谢耦合
A-C) 在鸡模型中,联合代谢与免疫标志物可提升死亡率预测性能。B, D-E) 在人类队列中,基于鸡源性代谢标志物的模型同样有效,但其性能受免疫标志物加入的影响与鸡模型相反,提示物种特异的免疫-代谢耦合。鸡死亡率与人类急性器官衰竭的生物标志物模式更相似,而非长寿模式。F) 标志物数量的增加在两种物种中均能协同提升预测性能。G) H与L组间代表性风险/保护性代谢物的积累差异。H) 生物标志物关联基因在人类疾病基因集中的富集分析,揭示了跨物种保守的病理生理通路。
Figure 6. 整合多组学揭示丁酸盐与L-半胱氨酸的遗传位点及其在Keap1/Nrf2通路中的拮抗作用
A) 丁酸盐mGWAS的曼哈顿图,定位到关键基因组区域。B-C) 内含子SNP rs318007359(位于MSRA基因)的A等位基显著增强启动子活性,导致MSRA表达与血清丁酸盐水平升高,并与高风险基因型相关。D-F) 类似地,内含子SNP rs732044877(位于PTER基因)的G等位基调控PTER表达与血清L-半胱氨酸水平。G-J) 体外实验表明,L-半胱氨酸通过双重机制协调抗氧化防御:一方面直接提升CAT、SOD、GPx的酶活性;另一方面,作为谷胱甘肽(GSH)前体,通过反馈抑制Keap1/Nrf2通路,下调Nrf2、NQO1、HO-1的转录表达,以实现代谢高效。I) 孟德尔随机化证实肠道菌群(Blautia、*Christensenellaceae_R-7_group*及其B/C比率)对丁酸盐水平的因果效应。K) 机理模型:丁酸盐(Nrf2激活剂)与L-半胱氨酸(酶激活剂/Nrf2反馈抑制剂)协同维持氧化还原稳态。