糖皮质激素诱导的TNFR相关蛋白(GITR)等共刺激受体在调节T细胞效应器功能中发挥关键作用。GITR在活化的T细胞中上调,在调节性T细胞上(Tregs)结构性性表达,GITR信号导致T 细胞激活、增殖、存活,并抑制Tregs的活性。然而,在人类临床试验中,GITR激动剂抗体的治疗效果有限,这可能是由于受体聚集介导的信号传导不理想所致。为了克服这一潜在限制,研究者开发了一种由抗PD-1抗体和多聚GITR配体(GITR-L)融合而成的双特异性分子,该抗体诱导PD-1依赖性和FcγR非依赖性GITR聚集,从而增强抗原特异性GITR+PD-1+T细胞的激活、增殖和记忆分化。
这种双特异性抗体的作用机制不同于抗PD-1和抗GITR抗体单一或联合疗法,因为它不依赖于PD-1饱和度、FcγR介导的T细胞激活或ADCC介导的Treg清除。抗PD-1/GITR-L双特异性代表了一种与众不同的癌症免疫治疗中T细胞活化的治疗方法。为了比较不同GITR受体聚集水平相对应的T细胞共刺激信号,研究设计了一系列不同的构建。通过基于GITR-1和抗GITR的工程化结构可以实现最佳的寡聚和生物活性。其中,十二价的GITR-L六聚体Fc构建中,观察到T细胞活性显著增加,包括IL-2和IFN-γ的分泌。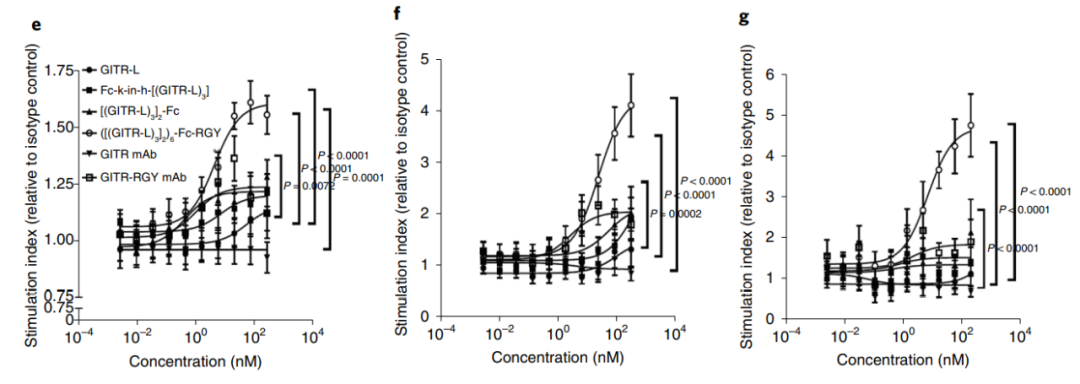
十二价抗GITR-L六聚体显示出比抗GITR抗体更高的活性,这表明当通过多个配体提供的强亲和力实现有效的GITR聚集时,GITR信号可以独立于FcγR而诱导。基于这一机制,研究设计了一种抗PD-1–GITR-L双特异性抗体,其中抗PD-L1增强了GITR聚集和NFκB信号。抗PD-1/GITR-L双抗在NFκB-GITR+Jurkat报告细胞中诱导了更高水平的NF-κB信号。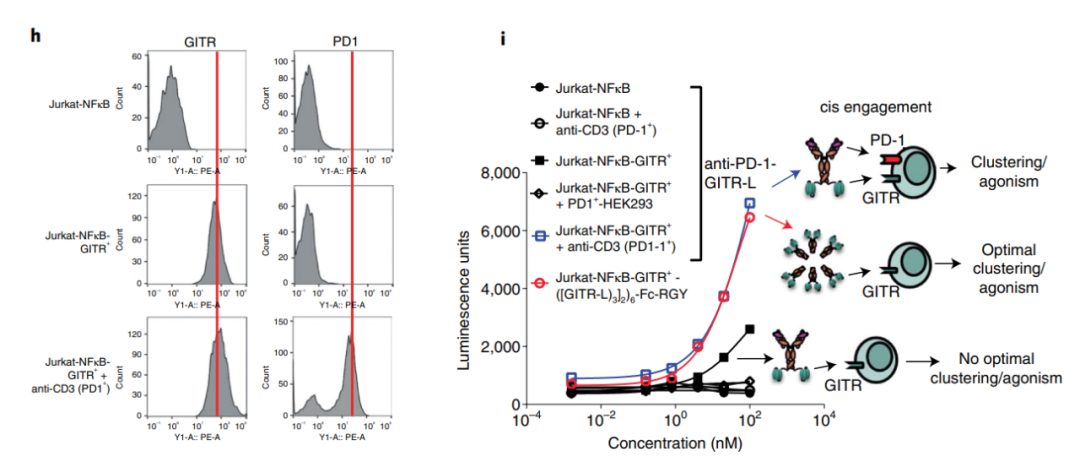
PD-1
和GITR在T细胞受体(TCR)激活的T细胞上共表达,根据mRNA-seq分析和免疫组织化学(IHC)结果,在不同癌症适应症的肿瘤浸润淋巴细胞中也发现高PD-1和GITR表达水平。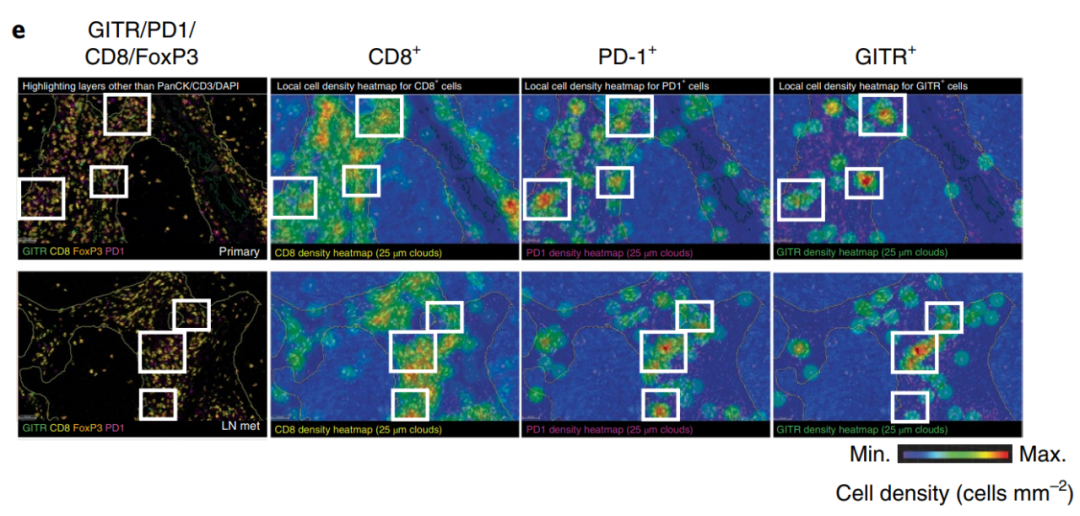
随后,在PD-1耐药模型中测试了抗PD-1/GITR-L双抗的抗肿瘤效果,同时比较了与抗PD-1和GITR-L的单药以及1:1联合。结果显示,相比于单药和联合给药,抗PD-1/GITR-L双抗显示出最优的抑制肿瘤效果。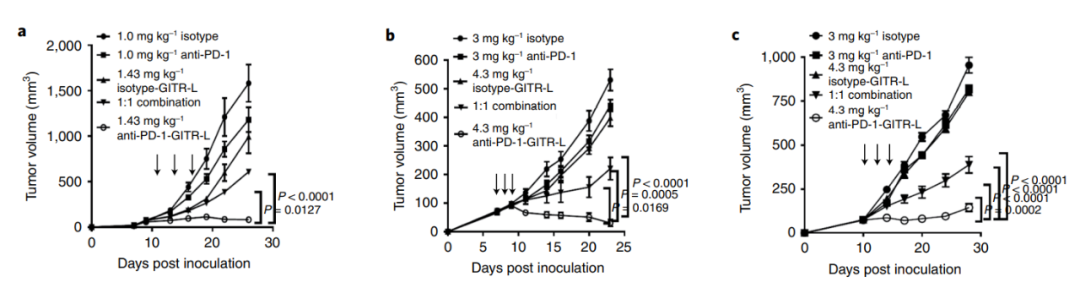
在人外周血单核细胞共刺激试验中,与单药和1:1联合给药相比,抗PD-1/GITR-L导致PBMC剂量依赖性增殖、IFN-γ、IL-2和TNF-β增强。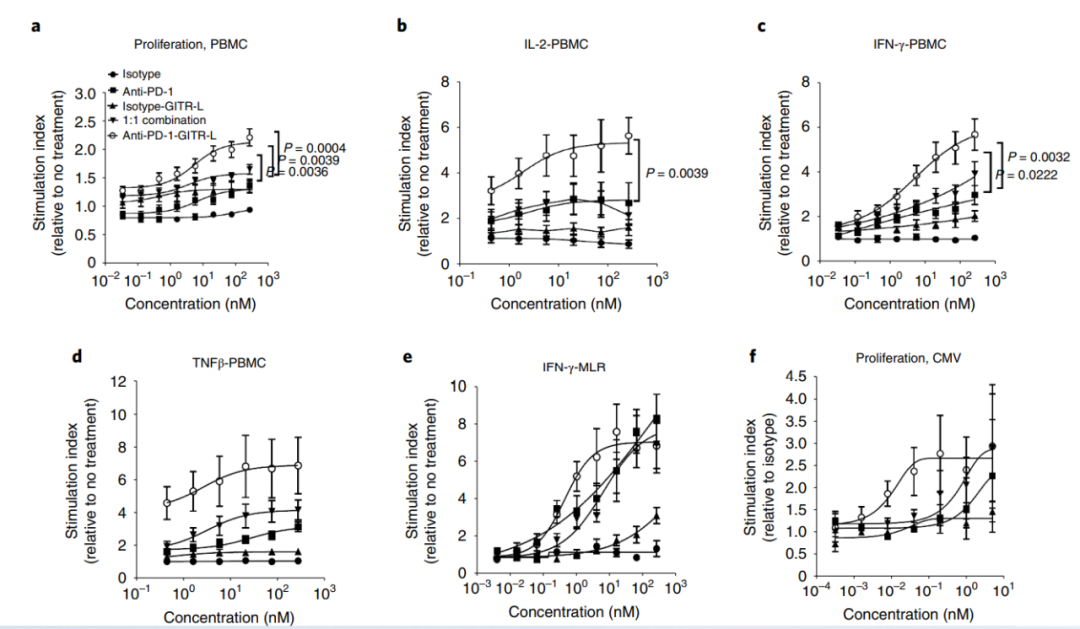
此外,与单药和联合给药相比,抗PD-1/GITR-L导致Teff(CD4+CD25-)细胞增殖的百分比更高。此外,由于最佳的GITR交联,仅在抗PD-1/GITR-L的双抗组中观察到在没有Treg细胞的情况下Teff细胞的增殖。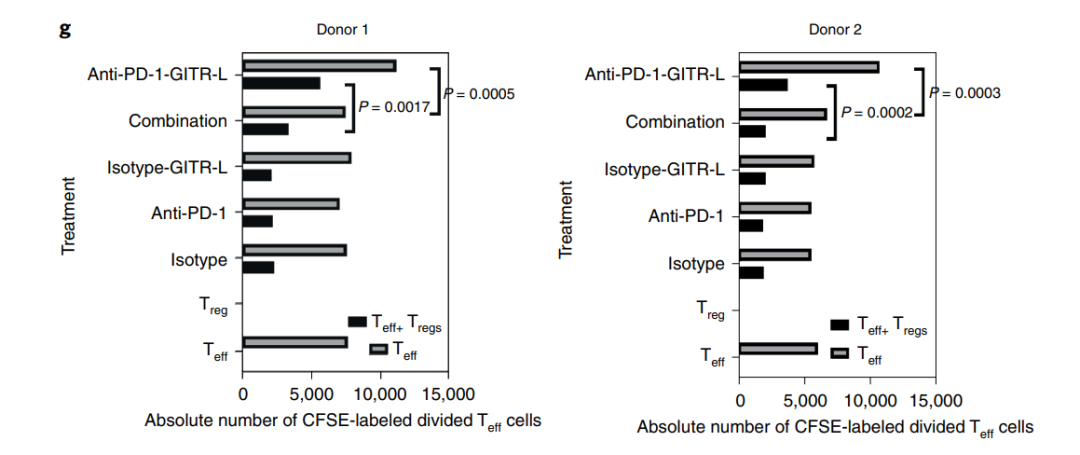
GITR信号通路是一个有吸引力的免疫肿瘤靶点,它能够促进效应T 细胞的功能并抑制调节T 细胞。然而,GITR的激动剂抗体在几个早期临床试验中仅显示出有限的治疗效果。因此,由于许多患者没有从中受益,人们仍在寻求更优的TNFRSF激动剂。通过将抗PD-1抗体与GITR-L融合,这种形式的双特异性抗体产生了最佳的GITR聚集效果。与单一疗法和联合疗法的效果相比,抗PD-1–GITR-L双特异性抗体具有不同的MoA,它诱导抗PD-1介导的GITR聚集和持续的T 细胞活化,产生了最优的抗肿瘤效果。总之,抗
PD-1/GITR-L双特异性抗体代表了一种有希望的免疫治疗方法,通过优化聚集介导的抗原特异性T细胞的共刺激来克服PD-1耐药患者的免疫逃逸。
1. An anti-PD-1–GITR-L bispecific agonist
induces GITR clustering-mediated T cell activation for cancer immunotherapy. Nat
Cancer.2022; 3(3): 337–354.
公众号已建立“小药说药专业交流群”微信行业交流群以及读者交流群,扫描下方小编二维码加入,入行业群请主动告知姓名、工作单位和职务。