*仅供医学专业人士阅读参考


众所周知,慢性HBV感染是导致肝细胞癌(HCC)发生的主要病因。
2018年数据显示,我国由于HBV感染造成的HCC新发病例高达25万例,约占全球HBV感染造成的肝癌新发病例的69%。截至目前,肝癌仍是我国第4位常见恶性肿瘤及第2位肿瘤致死病因[1]。
然而,在这个棘手的癌症面前,我们能做的也非常有限,一方面原因是,肝癌起病隐匿,发现时多为晚期,很多患者就丧失了接受肝切除、肝移植等根治性疗法的机会。另一方面,即便肝癌患者接受了根治性手术,术后肿瘤复发率仍然很高,5年复发率高达40%-70%[1]。
此外,在免疫疗法遍地开花的今天,我们依然无法打破肝癌患者5年生存率低的局面。因为就算是同一个免疫检查点抑制剂,治疗不同癌症的效果也可能大不相同,以PD-1/PD-L1抑制剂或CTLA-4抑制剂为例,其在临床实践中的有效率还不到20%,甚至多达40%的肝癌患者对这些药物没有反应。
因此,探索其他能激发更强大的抗肿瘤免疫反应的免疫检查点抑制剂,对HCC患者而言十分重要。
近日,中国科学技术大学免疫研究所所长、中国科学院天然免疫与慢性疾病重点实验室的田志刚院士及其团队,利用肝细胞替代技术构建了一个可以自然发生HBV相关HCC的小鼠模型(即HBs-HepR小鼠),并通过该模型探索了近几年免疫检查点抑制剂新秀——TIGIT抑制剂对HBV相关HCC的治疗效果,最终发现,肝内CD8+T细胞上TIGIT过表达是其耗竭的原因,阻断TIGIT可增强HBV相关HCC进展过程中CD8+T细胞的抗肿瘤活性。
相关研究成果发表在著名肝病学期刊Hepatology上[2]。

论文首页截图
作为近几年最有前途的免疫抑制分子,TIGIT可谓炙手可热。既往研究显示,TIGIT参与了NK细胞的耗竭,抑制TIGIT不仅能增强NK细胞的抗癌能力,还能让更多的CD8+T细胞被激活。
不过也有研究显示,仅仅当TIGIT抑制剂和PD-1/PD-L1抑制剂联用时才能在HCC小鼠模型中显示出治疗效果。然而以上通过敲除Trp53和过表达Myc(Trp53KO/C-MycOE)的HCC小鼠模型并不能展现人类从感染HBV进展到HCC这一过程。
因此,想要深入探讨阻断TIGIT对HBV相关HCC的治疗效果,一个靠谱且实用的HBV相关HCC小鼠模型至关重要。
鉴于HBV有严格的种属限制,想要真实地再现HBV感染的免疫和发病机制十分困难。为了解决这个问题,田志刚院士及其团队分离了HBs转基因(HBs-Tg)小鼠和野生型(C57BL6/J)小鼠的肝实质细胞,然后使用脾内转输的方法把肝实质细胞转输给免疫系统健全的Fah缺陷小鼠进行肝细胞重建,最终成功构建了HBs-Tg肝细胞取代小鼠(HBs-HepR)模型和其对照的B6-HepR小鼠模型。
相较于对照B6-HepR小鼠,在重建的14-60周后,HBs-HepR小鼠肝脏出现了不同程度的肝纤维化,在重建24-60周后,HBs-HepR小鼠表现为血清ALT和AST水平升高。
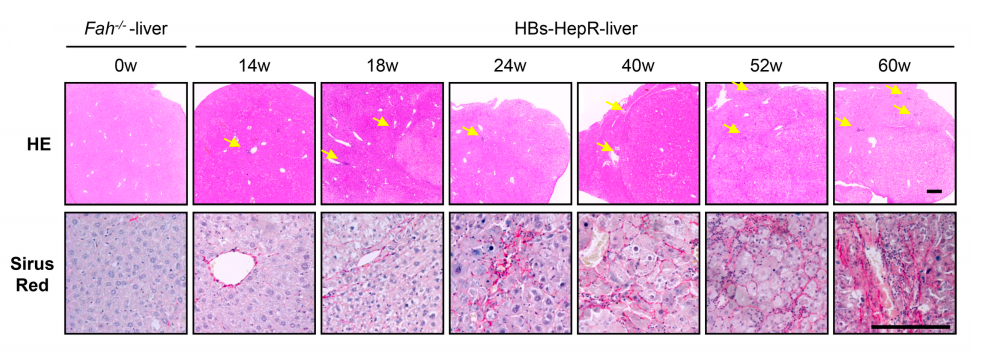
重建14-60周HBs-HepR小鼠肝脏组织学变化情况
在重建后的第24周,研究团队对HBs-HepR小鼠进行了RNA测序后发现,HBs-HepR小鼠的肝细胞增殖加速,并向恶性转化。当重建52周后,经肝组织HE染色鉴定,HBs-HepR小鼠肝脏中出现的肿瘤结节正是HCC结节,而不是再生结节。
更重要的是,这些HCC肿瘤细胞的HBsAg mRNA和Fah mRNA均呈阳性,也就是说,这些肿瘤细胞确实来源于HBs-Tg小鼠转移的肝细胞。此外,差异表达分析显示,该HBV相关HCC小鼠模型与人类HBV感染导致的HCC具有相同的分子表型。
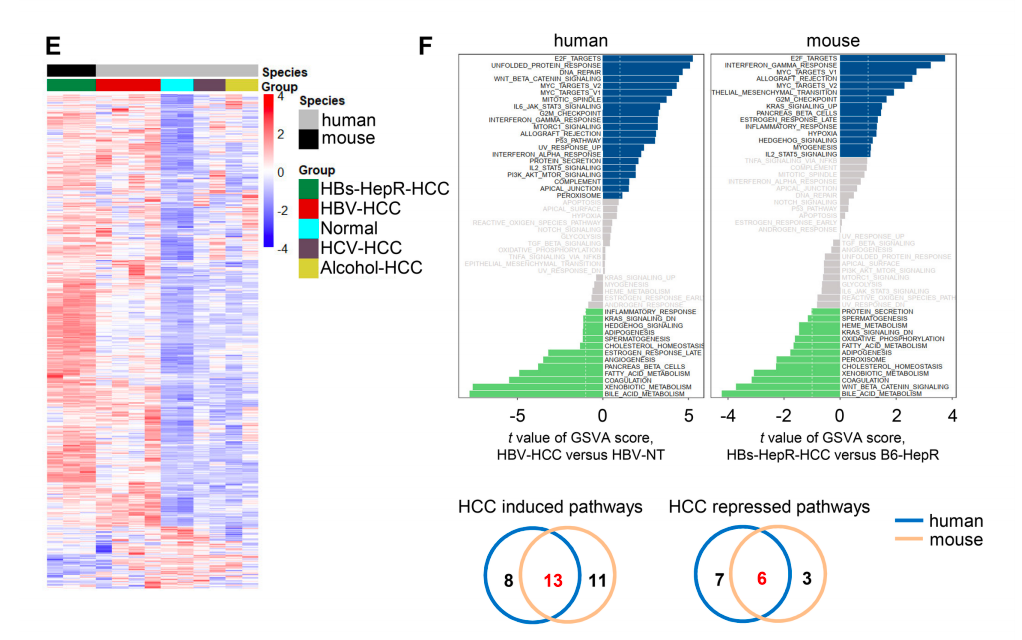
HBs-HepR小鼠模型与人类HBV感染导致的HCC具有相同的分子表型
这一发现也证明,HBs-HepR小鼠模型与已有的其他小鼠HCC模型不同,是可以实现自发HCC的。
现在小鼠模型有了,拿它类比研究HCC特征再合适不过了。
于是研究团队观察了重建24-60周后,HBs-HepR小鼠肿瘤周围的T细胞分布情况,结果发现,在重建40周时,所有HBs-HepR小鼠均发生了HCC。与对照组小鼠相比,HBs-HepR小鼠肿瘤周围聚集了大量的CD8+T细胞。随着HCC的进展,CD8+T细胞数量持续升高。
当重建60周后,HBs-HepR小鼠已进展到HCC晚期阶段,尽管在这一时期,HBs-HepR小鼠肿瘤浸润CD8+T细胞数量仍有很多,但是流式细胞仪分析显示,其肝内CD44+CD8+T细胞效应能力减弱,产生IL-2、TNF-α和IFN-γ水平降低。这也证明在HBs-HepR小鼠HCC晚期,肝内大量CD8+T细胞开始出现功能障碍。
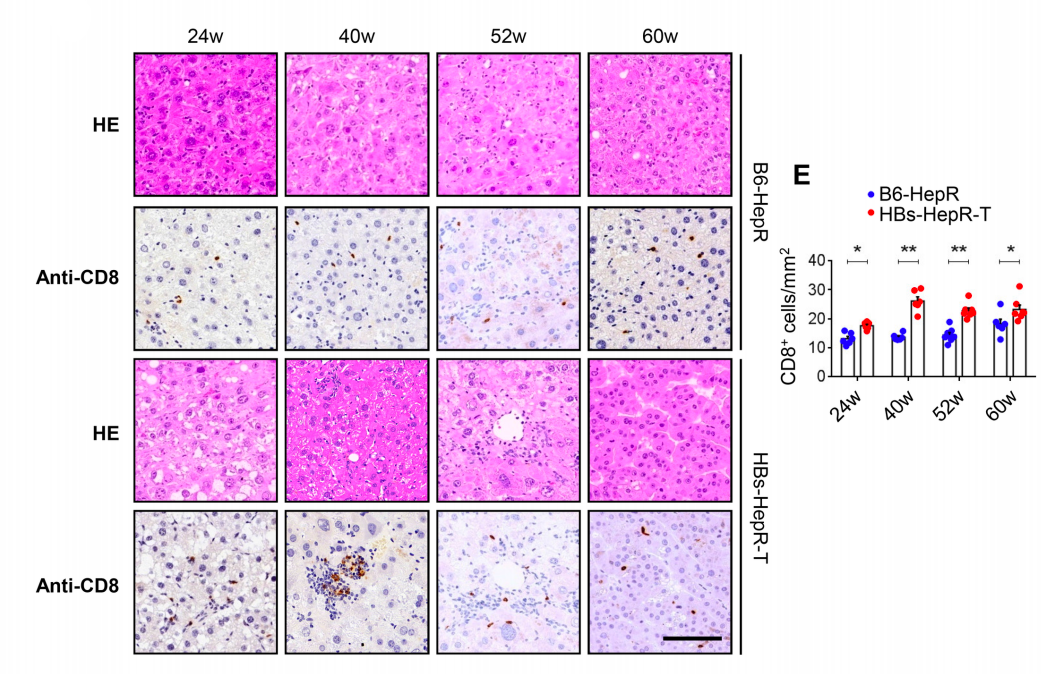
两组小鼠CD8+T细胞数量对比
研究团队随即对与CD8+T细胞耗竭相关的标记物进行分析后发现,HBs-HepR小鼠肝内CD8+T细胞上TIGIT水平明显更高于对照组小鼠。
我们知道,利用免疫检查点与其配体之间的相互作用机制来实现免疫逃逸,是癌症的主要标志。一般来讲,免疫检查点和它的配体是一对一或者一对多的关系,但TIGIT却涉及了多个受体(如CD96、CD112R)、一个竞争性共刺激受体(CD226)和多个配体(如CD155、CD112)。
在本文中,研究团队也对TIGIT的配体进行了分析,结果发现,在重建24周后,RNA测序分析显示,在HBs-HepR小鼠中,Pvr(CD155)表达显著上调。在重建40周、52周以及60周时,均观察到此类现象。此外,相较对照组,HBs-HepR小鼠肿瘤中的CD155表达更高,这与HBV相关HCC患者肿瘤细胞高表达CD155类似。
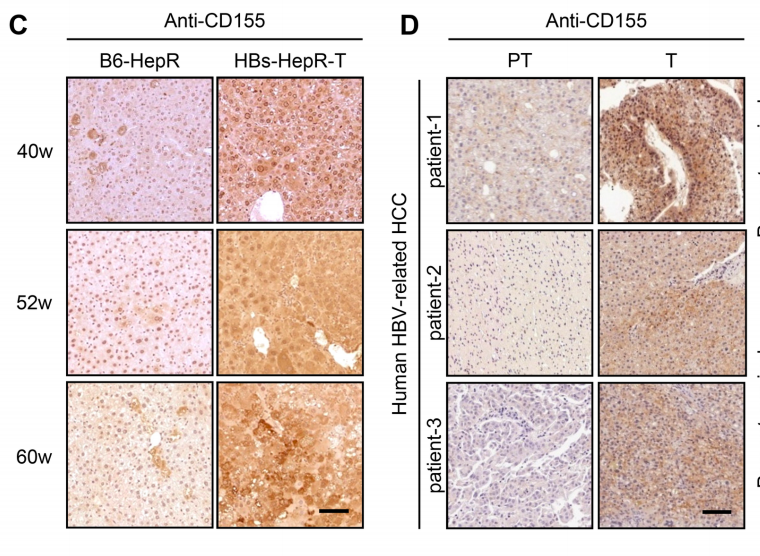
HBs-HepR小鼠与人肿瘤细胞中均存在CD155高表达
当然,TIGIT的另一种配体CD112,在HBV相关的HCC患者中也存在高表达,但CD112在肿瘤和瘤周组织中的表达水平相似,且与患者预后无关。
因此,研究团队认为,CD155才是可能导致TIGIT+CD8+T细胞耗竭的原因。
那么阻断TIGIT/CD155能阻止HCC进展,并让CD8+T细胞恢复活力吗?
为了厘清这些疑惑,在重建第40周时,研究团队利用TIGIT抑制剂(13G6)处理HBs-HepR小鼠。结果发现,13G6的确延缓了肿瘤的生长,肝体指数(HSI)也明显降低。
在重建52周后,研究测量了未经13G6治疗的HBs-HepR小鼠的HSI(平均值为12.365%),并将其作为评价后续免疫检查点抑制剂疗效的一个指标。结果发现,在30只接受13G6治疗的HBs-HepR小鼠中,有23只小鼠的HSI低于平均值,且对13G6有反应的这些小鼠们最大肿瘤体积和肿瘤结节数量也明显减少。这说明单独使用TIGIT抑制剂是可以减缓HCC进展的。
上文也提到,既往研究认为TIGIT抑制剂和PD-1/PD-L1抑制剂联用才能发挥更好的抗肿瘤效果。但当研究团队用IgG处理HBs-HepR小鼠后发现,29只小鼠中只有8只HSI低于平均值,而且与单独用TIGIT抑制剂相比,加用PD-L1抑制剂也并没有提高小鼠的抗肿瘤效果。
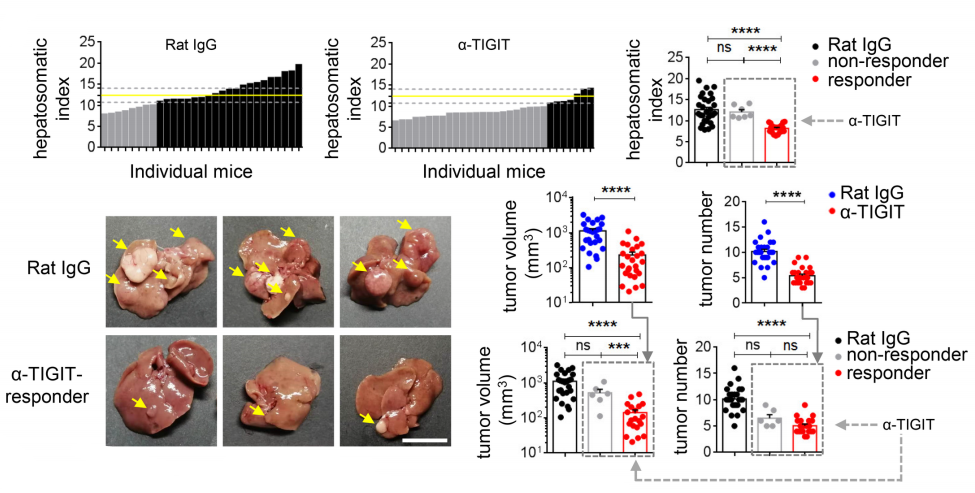
TIGIT抑制剂可让HBs-HepR小鼠肿瘤体积和肿瘤结节数量减少
在改善CD8
+T细胞功能方面,研究团队发现,TIGIT抑制剂可让产生IFN-γ和TNF-α的肿瘤浸润CD8+T细胞水平增加。这就意味着,TIGIT抑制剂至少能逆转大部分肿瘤浸润CD8+T细胞的耗竭状态。
总之,本研究构建了一个能自发HBV相关HCC的小鼠模型,发现TIGIT在HBV相关HCC的发生发展过程中起着重要的免疫调控作用,其过表达是CD8+T细胞耗竭的原因,单独阻断TIGIT就可以减缓肿瘤进展,并恢复部分CD8+T细胞的抗肿瘤效应。未来,针对TIGIT的免疫检查点抑制剂或许可以成为提高HBV相关HCC患者生存率的关键。

已购买课程的朋友,
直接进入小程序收听加餐哦~
参考文献:
[1]李照, 朱继业. 《原发性肝癌诊疗指南(2022年版)》解读[J]. 临床肝胆病杂志, 2022, 38(5): 1027-1029.
[2]Wu Y, Hao X, Wei H, Sun R, Chen Y, Tian Z. TIGIT blockade elicits potent anti-tumor immunity in naturally occurring hepatitis B virus-related hepatocellular carcinoma in mice. Hepatology. 2022 Aug 8. doi: 10.1002/hep.32715.

本文作者丨张金旭