*仅供医学专业人士阅读参考


既往研究表明,非小细胞肺癌(NSCLC)中,高密度的肿瘤浸润淋巴细胞(TILs)是预后更好的生物标志物,并与免疫治疗缓解反应相关[1]。
然而,目前评估TILs的标准方法是病理学家基于肿瘤常规组织病理苏木精-伊红染色(HE染色)切片进行的半定量评分,这种方法具有明显的缺点:主观性强、重复性差、半定量[2]。
计算机图形处理、人工智能算法研究已经在生物医学图像分析中显示出快速、可重复、定量的优点。结直肠癌[3]、黑色素瘤[4]中的初步研究显示,人工智能算法基于常规HE染色切片图像评估的TILs与患者的预后相关。
但是,基于机器学习(ML)的TILs计数能否用于PD-(L)1抑制剂的疗效预测目前尚不清楚。
近日,由哈佛大学布列根和妇女医院的David J. Kwiatkowski领衔的研究团队,进行了一项回顾性、多中心、发现-验证队列研究:探究晚期NSCLC患者中,建立基于ML的算法定量计数TILs的可行性,并评估TILs与免疫检查点抑制剂(ICI)单药治疗疗效的相关性[5]。
研究结果表明,基于ML的算法可以定量分析肺原发灶和各种转移灶的手术或活检常规组织病理HE染色图像中的TILs。他们还发现,高密度TILs(≥250个细胞/平方毫米)与免疫单药治疗无进展生存期(PFS)和总生存期(OS)均独立相关。具体来说,在发现队列中,高密度TILs与疾病进展风险下降29%,死亡风险下降26%相关;在验证队列中,高密度TILs与疾病进展风险下降20%,死亡风险下降25%相关。
值得一提的是,在PD-L1阴性(<1%)的患者中,TILs比肿瘤突变负荷(TMB)能更好的区分免疫单药治疗有无客观反应(完全缓解+部分缓解),曲线下面积(AUC)分别为0.77和0.65。该研究发表在JAMA Oncology上。

论文首页截图
接下来我们就一起来看看这个研究是如何展开的。
研究连续入组有组织病理确诊、且接受过PD-(L)1抑制剂单药治疗的晚期NSCLC患者,不论治疗线数。丹娜·法伯癌症研究所的446名患者为发现队列,中位随访38.1个月;英国帝国理工学院(n=78)和荷兰阿姆斯特丹大学医学中心(n=161)的239名患者为独立验证队列,中位随访43.3个月,仅发现队列有TMB数据。
基线特征方面,除了收集免疫治疗药物和线数、年龄、性别、组织病理类型、吸烟史、ECOG体能评分、PD-L1表达(肿瘤细胞阳性比例)、常见突变基因KRAS/EGFR的突变状态等,还特别收集了肿瘤病理组织的详细信息,包括来源(手术切除或活检)、类型(原发灶或转移灶)和部位(肺、淋巴结、胸膜、脑、肝、软组织和其他),完整地展示了晚期NSCLC患者肿瘤病理的多样性。
Kwiatkowski团队应用监督式的ML算法QuPath v.0.2.3分析病理图像计数TILs,整张HE染色切片除伪影和坏死区域外均纳入分析。其中,淋巴结因为可能含有正常淋巴组织和淋巴细胞,根据国际免疫肿瘤学生物标志物工作组指南[6],只对淋巴结内癌巢和癌巢的结缔组织基质进行分析。
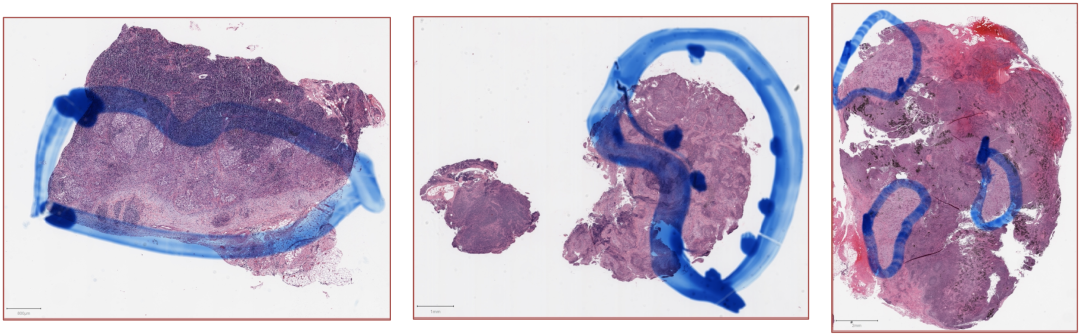
图1.三个淋巴结病理图像中进行分析的癌巢和癌巢的结缔组织基质被圈出。
总的来说,Kwiatkowski团队发现ML算法可定量计数肺原发灶和各种转移灶HE染色图像中的TILs。所有病理部位TILs密度的中位值为327(四分位164-681)个细胞/平方毫米,除肝转移灶TILs密度较低(中位值148个细胞/平方毫米)外,其他病理部位的TILs水平相似。
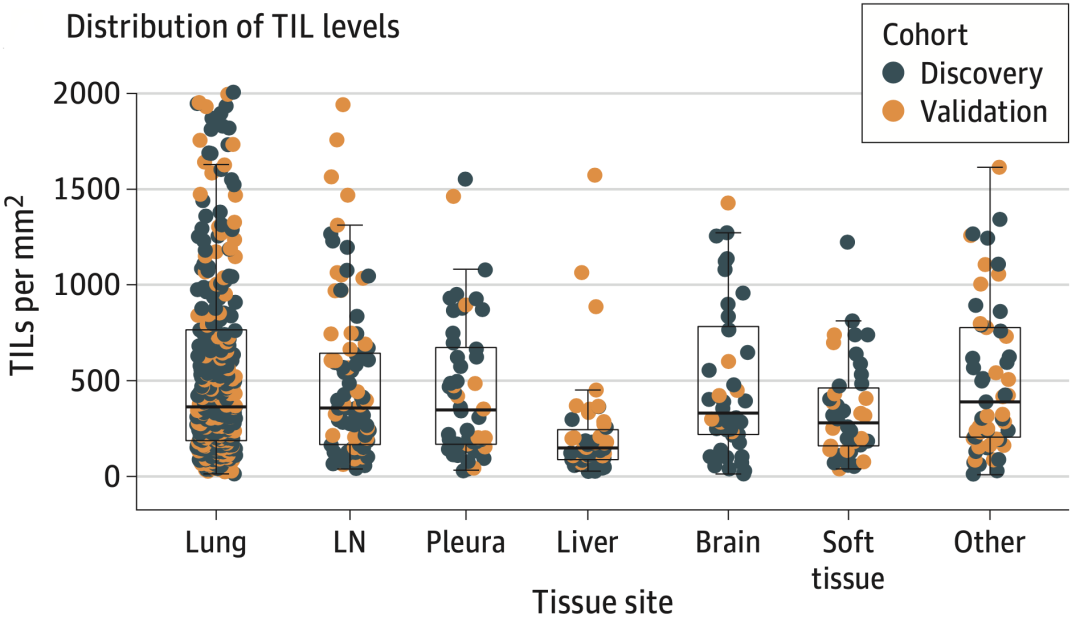
图2.除肝转移灶TILs显著较低外,其他病理部位TILs水平分布相似
Kwiatkowski团队先探索了TILs水平与PD-L1表达水平的相关性。他们发现,二者之间存在正相关关系,在PD-L1<1%、1-49%、≥50%亚组中,TILs水平依次升高,中位值分别为238、303、410个细胞/平方毫米。值得注意的是,在这个研究中,TILs水平与TMB无关,而且TMB与PD-L1表达也无关。
有趣的是,在KRAS突变型和野生型的肿瘤组织中,TILs水平无差异;而EGFR突变型TILs水平显著低于EGFR野生型,中位值分别位164、327个细胞/平方毫米,这与临床上EGFR突变患者应用免疫单药治疗效果欠佳相吻合。
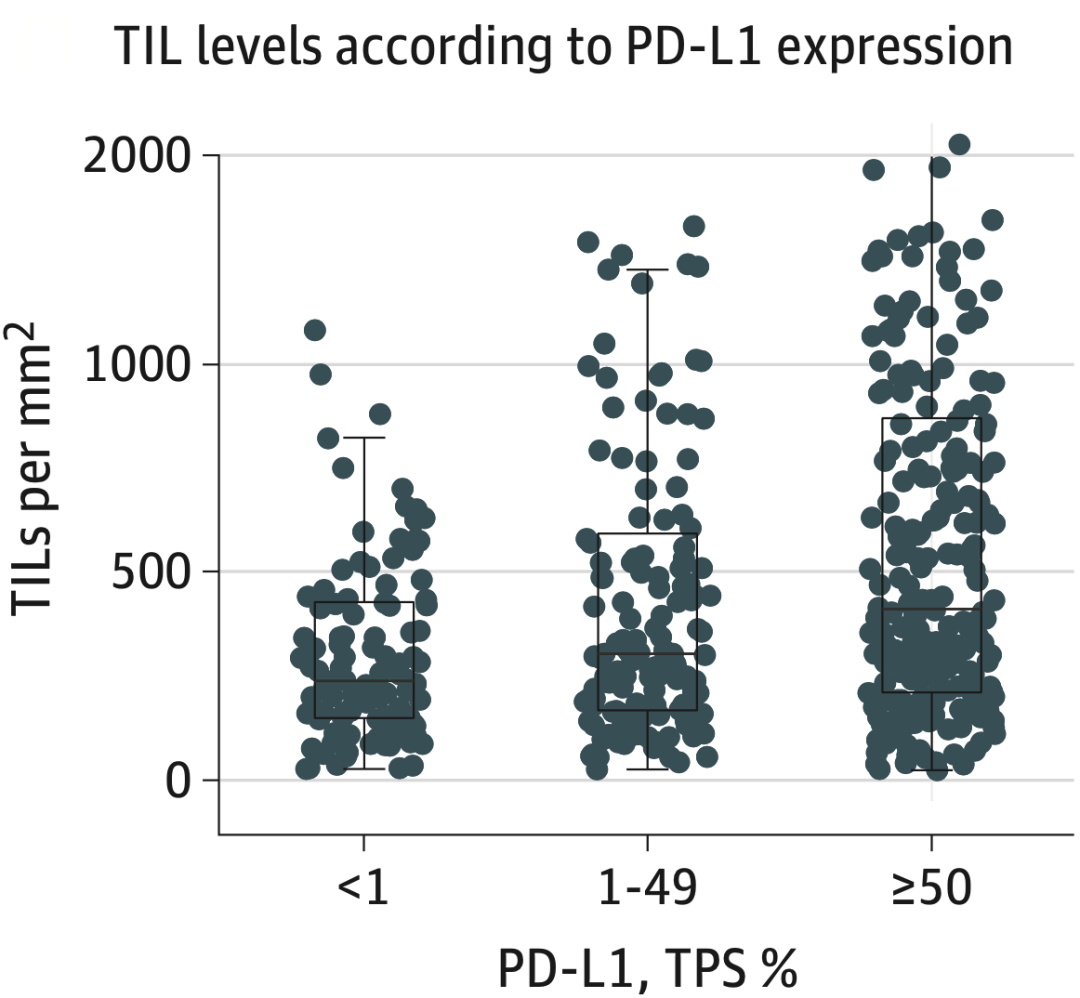
图3.在PD-L1<1%、1-49%、≥50%亚组中,TILs水平依次升高
为了确定TILs水平区分免疫治疗疗效的最佳截断值,Kwiatkowski团队将TILs水平作为二分类变量,计算不同TILs截断值下的高、低TILs两组间PFS的HR,并取最大的HR对应的TILs为最佳截断值。最终,在发现队列中,确定TILs最佳截断值为250个细胞/平方毫米。此外,发现队列与验证队列(293)、总队列(251)确定的TILs最佳截断值接近或一致。
单变量分析表明,在发现队列的TILs最佳截断值下,发现队列和验证队列的高TILs组均比低TILs组免疫单药治疗均显著获益:
中位PFS分别为3.8月vs2.9月(HR0.7,p=0.003)、6.3月vs1.7月(HR0.4,p<0.001),中位OS分别为15.5月vs11.8月(HR0.7,p=0.02)、13.1月vs5.7月(HR0.5,p<0.001)。不过,客观缓解率差异未达统计学显著性,分别为28% vs 22%、38% vs 30%。
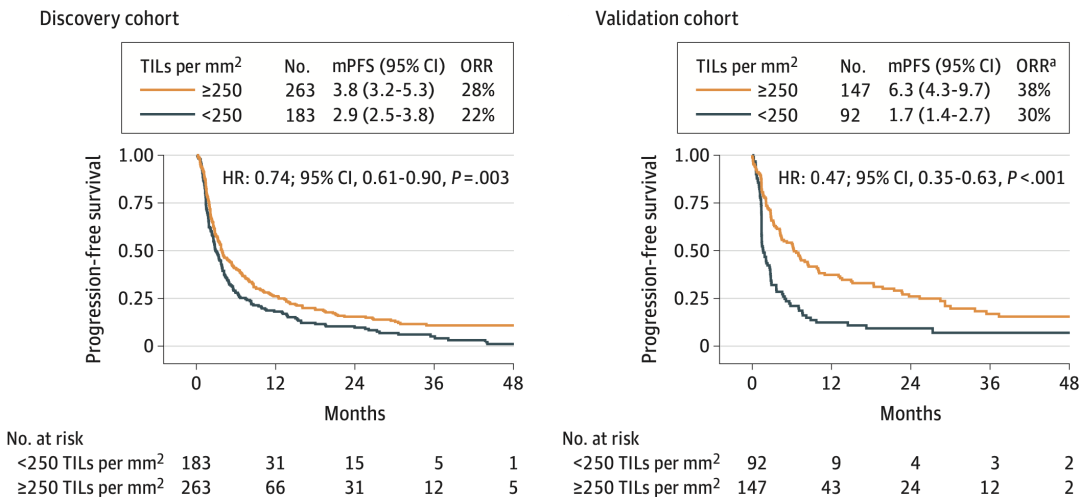
图4.单变量分析,在发现队列的TILs最佳截断值下,发现队列和验证队列的高TILs组均比低TILs组免疫单药治疗均显著获益
由于影响免疫治疗疗效的因素有很多,Kwiatkowski团队进行了多变量分析,确认了TILs与免疫治疗疗效独立相关。在发现队列,PFS的HR为0.71(p=0.006),OS的HR为0.74(p=0.03);在验证队列,PFS的HR为0.80(p=0.01),OS的HR的0.75(p=0.001)。
Kwiatkowski团队还对比了PD-L1、TILs、TMB分别预测免疫治疗客观缓解的效能,PD-L1最高(AUC为0.68,p<0.001),TMB其次(AUC为0.59,p=0.05),TILs最差(AUC为0.55,p=0.08)。
不过,在PD-L1阴性(<1%)的患者中,TILs比TMB能更好的区分免疫单药治疗有无客观缓解,TILs的AUC为0.77(p=0.02),TMB的AUC为0.65(p=0.30)。在PD-L1为1-49%和≥50%亚组,TILs和TMB区分有无客观缓解的效果均很差。
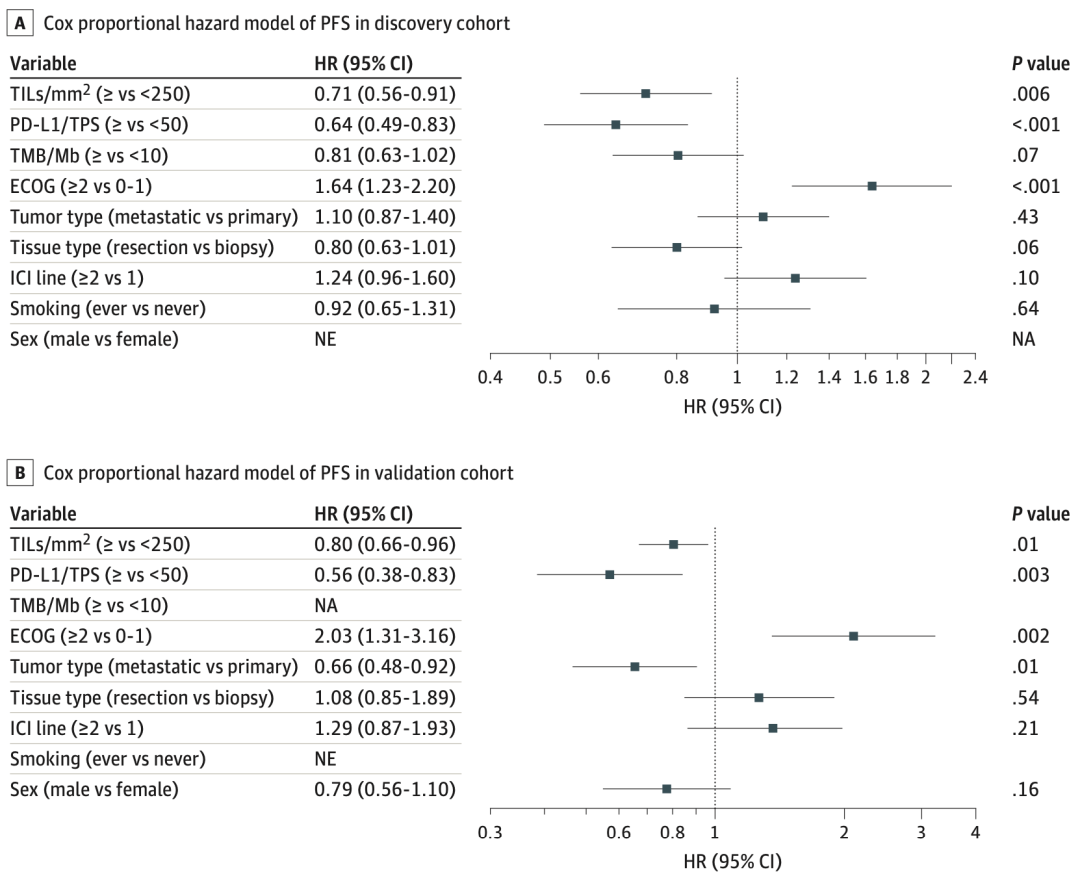
总的来说,Kwiatkowski团队的研究成果首次证实,在晚期NSCLC中,基于ML的算法可用于常规病理组织HE染色TILs计数,且高水平TILs(≥250个细胞/平方毫米)与免疫单药治疗获益独立相关。
虽然免疫治疗疗效预测生物标志物有很多,但一个普遍问题是高敏感性、低特异性。例如,在PD-L1阴性NSCLC患者中仍然有一定比例的免疫治疗获益人群。本研究表明综合运用不同疗效预测生物标志物有利于改善特异性,如在PD-L1阴性患者中找出能从免疫治疗中获益的个体。
在JAMA Oncology同期配发的评论中,耶鲁大学医学院的David L. Rimm认为,人工智能和机器学习有望实现较少人工参与的TILs计数,从而降低主观性、提高可重复性,并具有便捷、可重复、定量、降低成本等优点。但是距离临床应用,尚需解决开发过程中前瞻性验证、注册过程中算法代码开源、实际应用中支付方等诸多问题。

参考文献:
[1]. Gataa I, Mezquita L, Rossoni C, et al. Tumour-infiltrating lymphocyte density is associated with favourable outcome in patients with advanced non-small cell lung cancer treated with immunotherapy. Eur J Cancer. 2021;145:221-229. doi:10.1016/j.ejca.2020.10.017
[2]. Kos Z, Roblin E, Kim RS, et al. Pitfalls in assessing stromal tumor infiltrating lymphocytes (sTILs) in breast cancer. NPJ Breast Cancer. 2020;6:17. Published 2020 May 12. doi:10.1038/s41523-020-0156-0
[3]. Väyrynen JP, Lau MC, Haruki K, et al. Prognostic Significance of Immune Cell Populations Identified by Machine Learning in Colorectal Cancer Using Routine Hematoxylin and Eosin-Stained Sections. Clin Cancer Res. 2020;26(16):4326-4338. doi:10.1158/1078-0432.CCR-20-0071
[4]. Acs B, Ahmed FS, Gupta S, et al. An open source automated tumor infiltrating lymphocyte algorithm for prognosis in melanoma. Nat Commun. 2019;10(1):5440. Published 2019 Nov 29. doi:10.1038/s41467-019-13043-2
[5]. Rakaee M, Adib E, Ricciuti B, et al. Association of Machine Learning-Based Assessment of Tumor-Infiltrating Lymphocytes on Standard Histologic Images With Outcomes of Immunotherapy in Patients With NSCLC [published online ahead of print, 2022 Nov 17]. JAMA Oncol. 2022;10.1001/jamaoncol.2022.4933. doi:10.1001/jamaoncol.2022.4933
[6]. Hendry S, Salgado R, Gevaert T, et al. Assessing Tumor-Infiltrating Lymphocytes in Solid Tumors: A Practical Review for Pathologists and Proposal for a Standardized Method from the International Immuno-Oncology Biomarkers Working Group: Part 2: TILs in Melanoma, Gastrointestinal Tract Carcinomas, Non-Small Cell Lung Carcinoma and Mesothelioma, Endometrial and Ovarian Carcinomas, Squamous Cell Carcinoma of the Head and Neck, Genitourinary Carcinomas, and Primary Brain Tumors. Adv Anat Pathol. 2017;24(6):311-335. doi:10.1097/PAP.0000000000000161

责任编辑丨BioTalker