据 Insight 数据库统计,本周(7 月 9 日—7 月 15 日)全球共有 54 款创新药(含改良新)研发进度推进到了新阶段,其中 1 款获批上市,2 款申报上市,17 款获批临床,16 款申报临床。下文中,Insight 将分别摘取国内外部分重点项目做介绍。国内部分,本周共有 63 款创新药(含改良新)研发进度推进到了新阶段,其中 2 款获批上市,4 款申报上市,19 款获批临床,18 款申报临床。本周国内首次启动临床的 8 款创新药(含改良新)
 截图来自:Insight 数据库网页版(http://db.dxy.cn/)1、第一三共/阿斯利康:Enhertu 新适应症获批,HER2 低表达乳腺癌7 月 12 日,第一三共和阿斯利康共同宣布,优赫得®(ENHERTU®,注射用德曲妥珠单抗,Trastuzumab deruxtecan)获 NMPA 批准,单药适用于治疗既往在转移性疾病阶段接受过至少一种系统治疗的,或在辅助化疗期间或完成辅助化疗之后 6 个月内复发的,不可切除或转移性 HER2 低表达(IHC 1+或 IHC 2+/ISH-)成人乳腺癌患者。这意味着国内患者从此获得了首款用于 HER2 低表达乳腺癌的 HER2 靶向疗法,第一三共和阿斯利康也继 HER2 阳性乳腺癌之后再下一城,迅速在乳腺癌领域开疆扩土。此次获批是基于 DESTINY-Breast04 的 III 期临床研究结果。该试验结果首次于 2022 年美国临床肿瘤学会(ASCO)年会上发布,并发表于《新英格兰医学杂志》。此项批准前,中国国家药品监督管理局于 2023 年 2 月已批准了优赫得®适用于治疗既往接受过一种或一种以上抗 HER2 药物治疗的不可切除或转移性 HER2 阳性成人乳腺癌患者。
截图来自:Insight 数据库网页版(http://db.dxy.cn/)1、第一三共/阿斯利康:Enhertu 新适应症获批,HER2 低表达乳腺癌7 月 12 日,第一三共和阿斯利康共同宣布,优赫得®(ENHERTU®,注射用德曲妥珠单抗,Trastuzumab deruxtecan)获 NMPA 批准,单药适用于治疗既往在转移性疾病阶段接受过至少一种系统治疗的,或在辅助化疗期间或完成辅助化疗之后 6 个月内复发的,不可切除或转移性 HER2 低表达(IHC 1+或 IHC 2+/ISH-)成人乳腺癌患者。这意味着国内患者从此获得了首款用于 HER2 低表达乳腺癌的 HER2 靶向疗法,第一三共和阿斯利康也继 HER2 阳性乳腺癌之后再下一城,迅速在乳腺癌领域开疆扩土。此次获批是基于 DESTINY-Breast04 的 III 期临床研究结果。该试验结果首次于 2022 年美国临床肿瘤学会(ASCO)年会上发布,并发表于《新英格兰医学杂志》。此项批准前,中国国家药品监督管理局于 2023 年 2 月已批准了优赫得®适用于治疗既往接受过一种或一种以上抗 HER2 药物治疗的不可切除或转移性 HER2 阳性成人乳腺癌患者。
根据 DESTINY-Breast04 研究结果显示,与化疗相比,优赫得®治疗组将 HR 阳性及 HR 阴性的 HER2 低表达乳腺癌患者的疾病进展或死亡风险降低了 50%(危险比 [HR]=0.50;95% 置信区间 [CI]:0.40-0.63;p<0.0001)。通过盲态独立中心审查(BICR)评估,优赫得®治疗组的中位无进展生存期(PFS)为 9.9 个月(95%CI:9.0-11.3),而化疗组仅为 5.1 个月(95%CI:4.2-6.8),死亡风险降低 36%(HR=0.64;95%CI:0.49-0.84;p=0.001),接受优赫得®治疗的患者的中位总生存期(OS)为 23.4 个月(95%CI:20.0-24.8),而化疗组为 16.8 个月。
DB04 临床结果不仅成为 2022 ASCO 最亮的星,定义了乳腺癌领域新的治疗标准,也自此引爆了 HER2 ADC 乃至整个 ADC 赛道极大的热情。相应可能的受益群体,在乳腺癌中达到 50%。据阿斯利康此前分享的资料显示,乳腺癌中约 20% 患者为 HER2 阳性(IHC 3+),50% 的患者为 HER2 低表达(IHC 2+/IHC 1+),15-30% 的患者 HER2 极低表达(0 < IHC < 1+),5 - 20% 的患者为 HER2 阴性。乳腺癌中的 HER2 表达
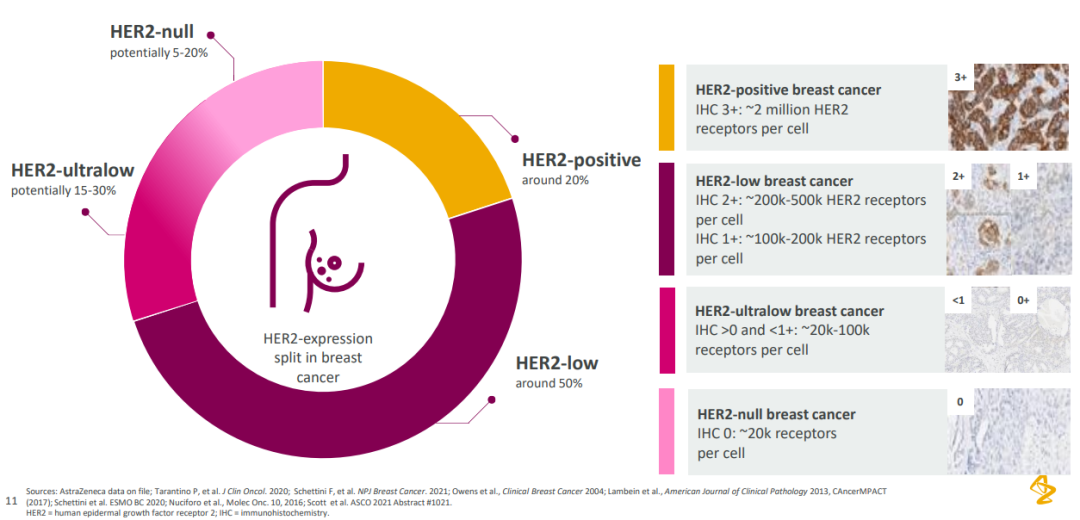
截图来自:阿斯利康 2022 ASCO 资料
基于 HER2 低表达乳腺癌这一全新分型,第一三共的布局还不止于此。针对更前线治疗,DB06 和 DB08 研究都已经在推进中。前者是一项 3 期临床,针对 HR 阳性、HER2 低表达乳腺癌患者治疗;后者是一项联合疗法 1b 期临床,评估不限 HR 表达状态的 HER2 低表达乳腺癌患者,联用药物包括阿斯利康 PD-L1 度伐利尤单抗、SERD 氟维司群等等。而其中,DB06 预计在今年读出临床结果。据 Insight 数据库显示,DB06 研究的中国部分早在 2020 年 11 月就已经公示启动(登记号:CTR20202365)。前线研究试验设计
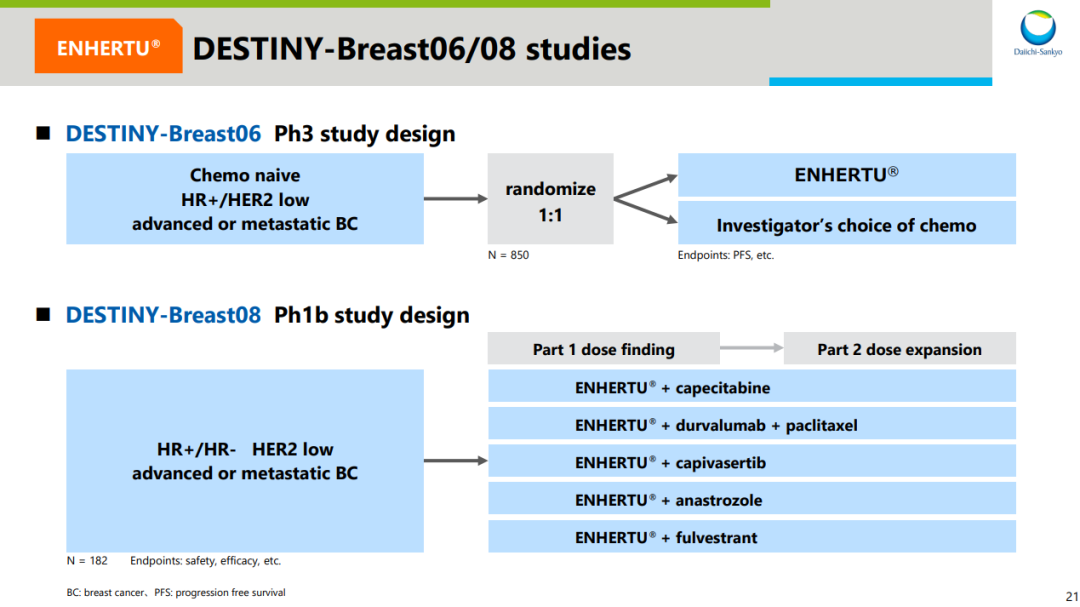
截图来自:第一三共官方资料
Enhertu 已经为第一三共带来巨大商业价值,自首次获批以来营收持续增长,2022 财年营收已达 15.84 亿美元,用时不到 3 年就已跨越 10 亿美元大关,很显然,随着适应症的不断拓展,后续市场潜力巨大。
截图来自:第一三共官方资料
而对于 HER2 ADC 领域,Enhertu 增加了想象力,也带来新的压力。在 HER2 低表达乳腺癌适应症上,国产 ADC 如今也已经竞相投入研发当中。
全球范围内针对 HER2 低表达乳腺癌启动临床的 HER2 ADC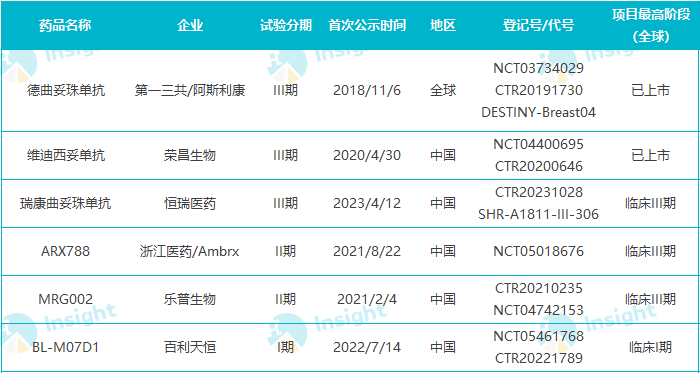
数据整理自 Insight 数据库全球临床试验模块
2、葛兰素史克:长效 HIV 疗法「卡替拉韦」获批上市7 月 13 日,据 NMPA 官网显示,GSK 卡替拉韦注射液与卡替拉韦钠片国内获批上市(受理号:JXHS2101083/JXHS2101085)。卡替拉韦(Cabotegravir)是一款长效 HIV-1 整合酶链转移抑制剂(INSTI),通过阻止病毒 DNA 整合到人类免疫细胞(T 细胞)的遗传物质中来抑制 HIV 复制。
据 Insight 数据库显示,卡替拉韦此前已于 2020 年 12 月获 EMA 批准上市,此后又获得美国 FDA 批准,在国内,卡替拉韦于 2021 年 11 月首次申报上市,并于近日获批。
卡替拉韦全球项目开发关键节点

截图来自:Insight 数据库网页版
卡替拉韦与利匹韦林联用,可每月一次或每两个月注射一次治疗 HIV 感染患者。2021 年 1 月,FDA 批准其每月一次的给药方案,用于治疗接受抗逆转录病毒治疗后出现病毒学抑制的成人 HIV-1 感染患者;2022 年 2 月 FDA 批准了每两个月一次的给药方案。
据此前披露的关键 III 期 ATLAS 和 FLAIR 研究结果显示,在为期 48 周的治疗期间,每月臀部肌肉注射一次持续病毒抑制效果与每日口服三联疗法(2 款核苷逆转录酶抑制剂(NRTIs)联用整合酶抑制剂 (INI),NNRTI,或蛋白酶抑制剂 (PI))相同。且有 90% 受试者表示与之前接受每日口服疗法相比更喜欢每月注射 1 次的疗法。
此外,另一项 III 期临床试验显示,在接受该组合疗法的第 48 周时,每两个月一次用药方案的患者中血浆 HIV-1 RNA≥50 拷贝/毫升的患者比例,与每月一次用药方案相比达到非劣效性。
7 月 11 日,君实生物宣布,NMPA 已受理其自主研发的抗 PD-1 单抗特瑞普利单抗联合阿昔替尼用于不可切除或转移性肾细胞癌(RCC)患者一线治疗的新适应症上市申请。
当前,国产 PD-(L)1 抑制剂并未有申报晚期肾细胞癌,特瑞普利单抗为国产首款。这是特瑞普利单抗在中国递交的第 9 项上市申请,此前已在国内获批 6 项适应症,且另有 2 项适应症已处于上市申请阶段。特瑞普利单抗申报/获批适应症
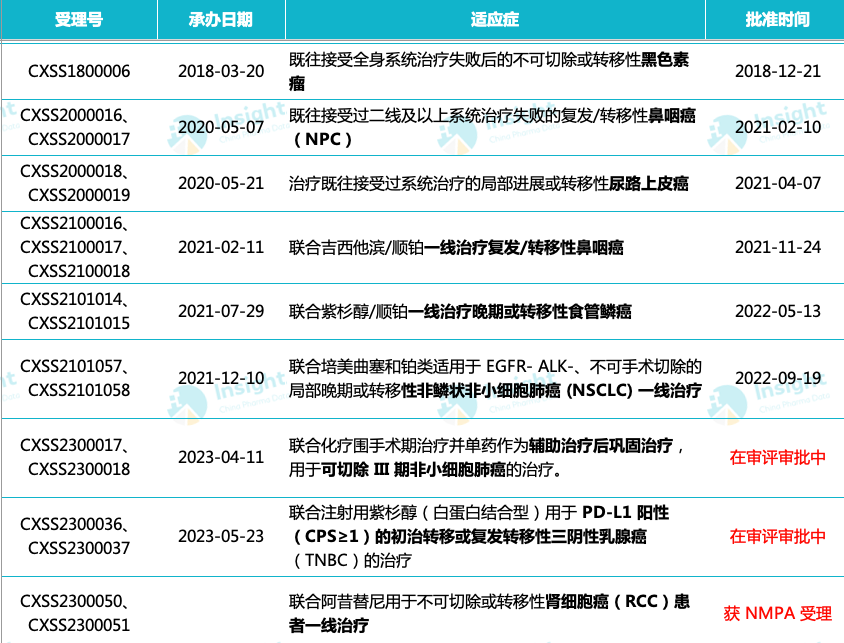
来自:Insight 整理(人工整理,如有纰漏请指正)
本次新适应症的上市申请主要基于 RENOTORCH 研究(登记号:NCT04394975)。作为国内首个晚期肾癌免疫治疗关键 III 期研究,RENOTORCH 研究为一项多中心、随机、开放、阳性药对照的 III 期临床研究,旨在评估特瑞普利单抗联合阿昔替尼对比舒尼替尼一线治疗中高危的不可切除或转移性 RCC 患者的有效性和安全性。主要研究终点是独立评审委员会(IRC)评估的 PFS,次要研究终点包括研究者评估的 PFS、IRC 或研究者评估的 ORR、缓解持续时间(DOR)和疾病控制率(DCR)、OS 以及安全性等。北京大学肿瘤医院郭军教授和上海交通大学医学院附属仁济医院黄翼然教授为该研究的共同牵头主要研究者。研究于 2020 年 8 月启动入组,47 家国内中心参研,共随机入组 421 例受试者。根据 RENOTORCH 研究的期中分析结果,相较于舒尼替尼,特瑞普利单抗联合阿昔替尼一线治疗晚期 RCC 患者可显著降低患者的疾病进展或死亡风险,同时改善 ORR 等次要终点。特瑞普利单抗安全性数据与已知风险相符,未发现新的安全性信号。关于详细的研究数据,君实将在近期国际学术大会上公布。
肾癌是全球泌尿系统第三位最常见的恶性肿瘤,而 RCC 占全部肾癌病例的 80%~90%。据统计,2022 年中国肾癌新发病例和死亡病例分别约为 7.7 万例和 4.6 万例。约三分之一的肾癌患者在初诊时已发生肿瘤远处转移,而局限性患者接受肾切除术后仍有 20-50% 出现肿瘤远处转移。基于国际转移性肾细胞癌数据库联盟的风险分级,低危、中危和高危的转移性 RCC 患者接受抗血管靶向治疗的中位总生存期(OS)分别为 35.3、16.6 和 5.4 个月。因此,相较于低危患者,中、高危晚期 RCC 患者对新型治疗方案的临床需求更加迫切。当前,针对晚期肾癌的标准治疗仍以 TKI 靶向药单药治疗为主,患者通过该方案的获益十分有限。而特瑞普利单抗该项新适应症的申报上市,意味着我国肾癌治疗领域有望迎来首个「免疫+靶向」联合疗法。据 Insight 数据库显示,除特瑞普利单抗外,目前国内共有 4 款 PD-(L)1 抑制剂肾细胞癌适应症开发进度较快,分别为默沙东 K 药、BMS O 药、罗氏的阿替利珠单抗、正大天晴的 TQB2450,均处于 III 期临床阶段。7 月 12 日,CDE 官网显示,复星医药/Ardelyx 共同开发的盐酸替纳帕诺片(Tenapanor)申报上市获受理,用于终末期肾脏病血液透析患者(ESRD-HD)高磷血症的治疗。复星医药于 2017 年 12 月与 Ardelyx 公司达成合作,获得了 Tenapanor 在中国大陆、香港及澳门特别行政区的独家临床开发和商业化等许可。Tenapanor 是一款钠/氢交换蛋白 3(NHE3)小分子抑制剂,已于 2019 年 9 月获 FDA 批准上市,用于便秘性肠易激综合症的治疗,2023 年 3 月在中国香港特别行政区递交上市申请。不过对于高磷血症而言,当前 Tenapanor 暂未在全球监管机构取得批准,海外也处在上市审评当中。2020 年 9 月 15 日,Ardelyx 首次向 FDA 递交 Tenapanor 用于透析成人 CKD 患者血清磷控制的新适应症上市申请。这项 NDA 得到三项成功的 3 期临床试验的支持,共涉及 1,000 多名患者。其中包括两项单药治疗试验,分别为一项长期研究,以及一项双重机制疗法用于磷酸盐结合剂治疗仍难以控制的高磷血症(≥5.5 mg / dL)透析患者。
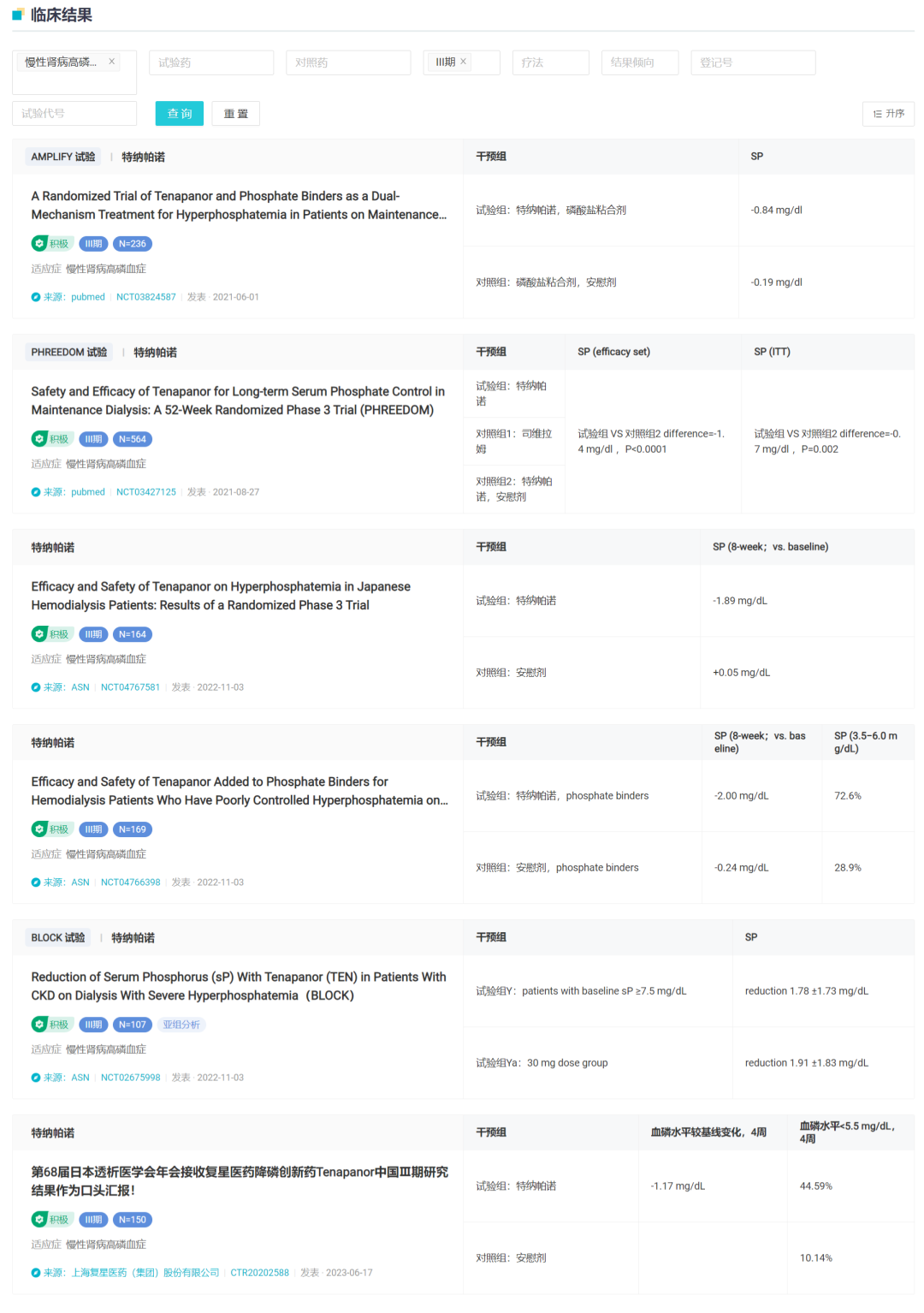
不过,在 2021 年 4 月,这项 sNDA 遭 FDA 延期要求补充分析,同年 7 月,Aldelyx 收到了 FDA 发出的 CRL,拒绝了该适应症的批准。当月,Aldelyx 股价暴跌超 70%。
一时的挫折并未使 Aldelyx 放弃这一适应症的开拓。2023 年 4 月,该公司重新提交了替纳帕诺的 sNDA 申请,用于对磷酸盐结合剂疗法反应不足或不耐受的接受透析治疗的成年慢性肾病患者血清磷酸盐的控制。该项申请基于一系列临床数据的支持,包括 1,200 多名患者参与的 3 项 III 期临床试验(试验代号:PHREEDOM、BLOCK 和 AMPLIFY),以评估替纳帕诺的安全性和有效性,所有试验均达到主要和关键次要终点;以及另外 2 项 IV 期开放标签临床试验(试验代号:OPTIMIZE 和 NORMALIZE)。
目前据 Insight 数据库显示,替纳帕诺用于高磷血症的适应症已经在日本、美国、中国同时进入监管审查当中。
基于替纳帕诺,原研公司 Aldelyx 达成了广泛的合作:日本权益授权给协和麒麟,中国权益属于复星医药,加拿大权益属于 Knight Therapeutics。最早在 2012 年还曾与阿斯利康达成交易,不过 2015 年双方终止了交易。
而其中复星医药的引进交易金额总额超过 1.25 亿美元,具体包括 3000 万美元的许可费用、商业化后根据产品销售额支付至多 9500 万美元的销售里程碑款项、以及 14%~20% 的销售提成。
目前,根据 Insight 数据库,复星医药在国内登记了两项临床试验,包括一项用于便秘型肠易激综合征的 I 期临床和一项用于终末期肾病高磷血症的 III 期临床,均已完成。在本次新适应症报上市之前,复星也在第 68 届日本透析医学会年会上以口头汇报公布了中国人群 III 期临床试验积极结果。
Tenapanor 国内临床研发甘特图
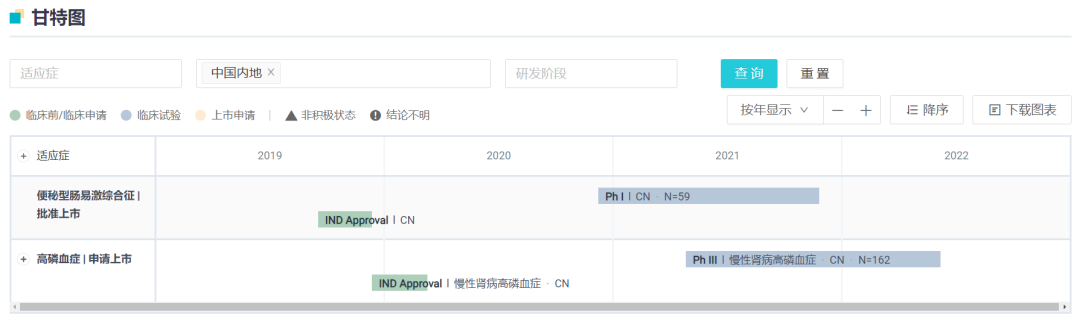
截图来自:Insight 数据库网页版
7 月 13 日,据 CDE 官网显示,瓴路药业注射用泰朗妥昔单抗申报上市(受理号:JXSS2300057)。这也是国内首款申报上市的 CD19 ADC。
泰朗妥昔单抗(Loncastuximab tesirine)是由瓴路药业和 ADC Therapeutics 创立的合资企业瓴路爱迪思开发的一款靶向 CD19 的 ADC 产品。当 Loncastuximab tesirine 与表达 CD19 的肿瘤细胞结合时,会被细胞内化,随后释放吡咯并苯二氮杂䓬二聚体(PBD)细胞毒素。PBD 与 DNA 小沟结合,形成强效的细胞毒性 DNA 链间交联,导致 DNA 复制停滞,阻断细胞周期从而导致肿瘤细胞死亡。而因 PBD 交联引起的 DNA 修复机制微小且易于隐藏,因此并不会改变 DNA 的结构。最终,Loncastuximab tesirine 能够使细胞周期阻滞从而导致肿瘤细胞死亡。此次申报上市,基于一项 II 期注册临床 OL-ADCT-402-001 研究结果。OL-ADCT-402-001 试验是一项开放性、单臂研究,旨在评估 Loncastuximab tesirine 单药用于治疗复发/难治性弥漫大 B 细胞淋巴瘤(r/r DLBCL)中国患者的有效性和安全性,此研究设置的主要终点指标为总体缓解率(ORR),次要终点指标为缓解持续时间(DOR)、完全缓解(CR)率及无进展生存期(PFS)等。今年 4 月,瓴路爱迪思宣布,该项研究达到主要研究目的,并证明了其有效性与安全性数据与全球关键临床试验 ADCT-402-201 结果一致。目前,在国内,瓴路爱迪思正在中国开展另一项针对 R/R DLBCL 患者的确证性 III 期临床试验 ADCT-402-311 研究。这也是 Loncastuximab tesirine 的全球确证性 III 期注册临床试验,旨在评估 Loncastuximab tesirine 联合利妥昔单抗(Lonca-R)对比利妥昔单抗联合吉西他滨及奥沙利铂(R-GemOx)的有效性和安全性。如若 Loncastuximab tesirine 获 NMPA 附条件批准,该研究将为其单药治疗 R/R DLBCL 的完全批准提供科学依据,同时其作为 R/R DLBCL 二线联合疗法未来在中国也有望获批,进一步扩大患者获益。从全球来看,Loncastuximab tesirine 于 2021 年 4 月获 FDA 加速批准,成为当前首个也是唯一一个靶向 CD19 的 ADC 药物,用于单药治疗此前至少接受过 2 线及以上系统性治疗的 R/R DLBCL 成人患者,包括非特定类型的 DLBCL、低分化淋巴瘤转化的 DLBCL 和高级别 B 细胞淋巴瘤。2022 年 12 月,Loncastuximab tesirine 亦得到欧洲药品管理局(EMA)的附条件批准。Loncastuximab tesirine 全球项目开发关键节点

截图来自:Insight 数据库网页版
据 Insight 数据库显示,这也是国内首款申报上市的 CD19 ADC,同时也远远领先于其他布局者,除瓴路爱迪思外,当前暂无有进入临床阶段的 CD19 ADC,不过,国产 ADC 先驱者荣昌生物也布局了 CD19 ADC,目前仍处于临床前阶段。康方生物:头对头比拼!卡度尼利单抗挑战替雷利珠单抗7 月 13 日,Insight 数据库显示,康方生物登记了一项新的头对头 III 期临床,评估卡度尼利单抗(AK104)联用化疗头对头替雷利珠单抗联用化疗一线治疗 PD-L1 阴性 NSCLC 的疗效和安全性。
这已经是康方启动的第 3 项头对头 PD-1 单抗的 III 期临床试验,至此,康方双抗管线中的两大核心产品——AK112 和 AK104,均已启动头对头替雷利珠单抗的 III 期研究。
据 Insight 不完全统计,当前国内企业登记的临床 II 期及以上 PD-(L)1 头对头试验已有 11 项之多,恒瑞、信达、百济这些主要玩家纷纷入局,天晴、康方、复宏汉霖等也不甘示弱。在适应症上,NSCLC 这一关键癌种毫无意外被集火;在对照药上,K 药帕博利珠单抗和百济神州的替雷利珠单抗是两大接受挑战的主力。从靶点/机制来看,大致可分为 3 类:1)单药头对头「硬碰硬」;2)联合用药方案的探索,联用 TIGIT 单抗、LAG3 单抗等免疫疗法,或联用以抗血管生成药物为主的小分子化药;3)下一代双抗药物的开发,这部分以康方为翘楚。PD-(L)1 抗体头对头临床试验列表
*本表格未计入 ADC 联合疗法研究
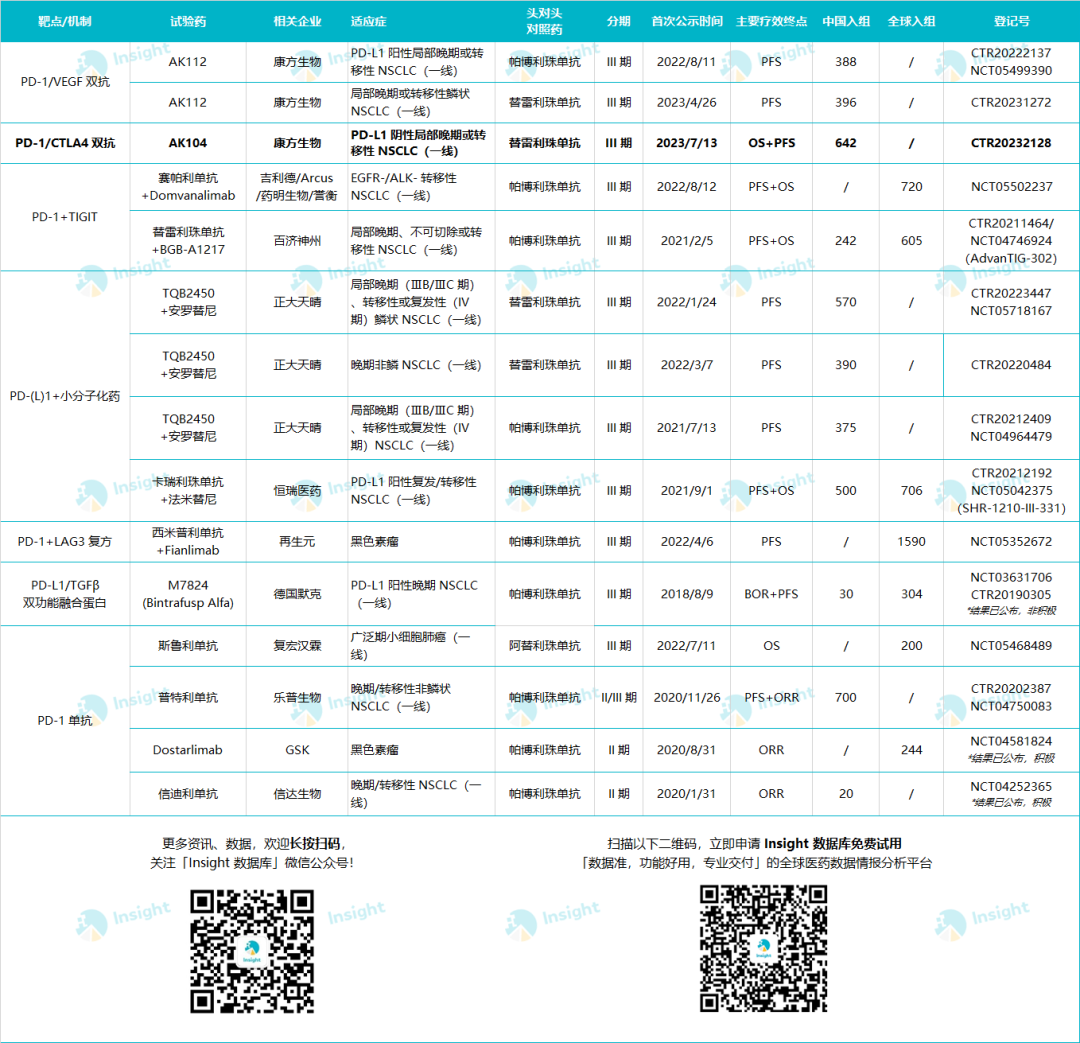
数据来自:Insight 数据库
内容为人工整理,如有遗漏,欢迎评论补充
本次康方启动的头对头新研究,是继百济和恒瑞之后,第 3 家采用 OS+PFS 双终点的中国企业头对头研究。
康方生物是国内双抗龙头,近期研发也是不断提速。6 月末,康方第 4 款双抗药物刚刚申报临床,即靶向 PD-1/CD73 的 AK131;7 月初,康方又申报了第 5 款双抗,即靶向 CD47/CLDN18.2 的 AK132。康方管线内 6 款双抗,其中 5 款已进临床
截图来自:Insight 数据库网页版
境外部分,本周共有 7 款创新药(含改良新)研发进度推进到了新阶段,其中 1 款获批上市,5 款获批临床,1 款申报临床。7 月 12 日,百济神州宣布 FDA 已受理布鲁顿氏酪氨酸激酶抑制剂(BTKi)百悦泽®(中文通用名:泽布替尼)在美国的第 5 项新适应症上市许可申请(sNDA)。该新适应症为泽布替尼联合奥妥珠单抗用于治疗既往至少经过二线治疗后复发或难治性(R/R)滤泡性淋巴瘤(FL)成人患者。此前,该适应症已获得 FDA 授予的「快速通道」资格和「孤儿药」认定。根据《处方药使用者付费法案》,美国 FDA 预计将于 2024 年第一季度对该项申请做出决定。本次新适应症的上市许可申请,是基于 2 期 ROSEWOOD 临床试验(登记号:NCT03332017)的结果。ROSEWOOD 是一项随机、开放性的 2 期临床研究,旨在评估泽布替尼联合奥妥珠单抗与奥妥珠单抗单药治疗既往接受过二线或以上治疗的 R/R FL 患者。该试验的主要终点是总缓解率(ORR),由独立评审中心(ICR)根据卢加诺(Lugano)分类标准评估;该实验选定的次要终点包括:研究者评估的 ORR、ICR 审查和研究者评估的缓解持续时间(DOR)和无进展生存期(PFS)、总生存期(OS)和安全性分析。在该试验的主要分析中,中位随访时间为 12.5 个月;泽布替尼与奥妥珠单抗联合治疗相较奥妥珠单抗单药治疗,在有效性方面展现出优效性,总缓解率(ORR)分别为 68.3% 和 45.8%(p = 0.0017);18 个月缓解持续时间(DOR)的无事件率可达 69.3%。此外,已递交的泽布替尼 R/R FL 适应症申请相关申报材料,已于近期开始接受欧盟和中国药监机构的审评,并已于早先在 ACCESS 联盟(ACCESS consortium)下的瑞士、英国和加拿大接受审评。
泽布替尼已在全球超过 65 个市场获批多项适应症,其中包括美国、中国、欧盟和英国、加拿大、澳大利亚、韩国、瑞士等国家和地区。其全球临床试验项目已在 29 个国家和地区入组超过 4,900 例受试者。泽布替尼全球临床试验
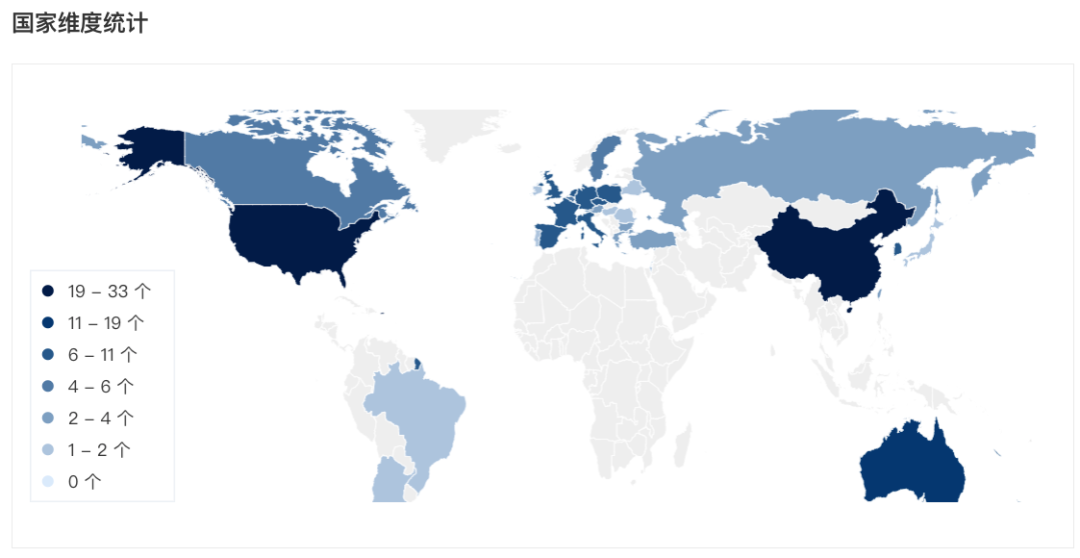
截图来自:Insight 数据库网页版
7 月 13 日,罗氏官网宣布,其评估 CD20 单抗奥瑞珠单抗每年两次、每次 10 分钟皮下注射治疗复发性多发性硬化症(RMS)或原发性进行性多发性硬化症(PPMS)患者的 III 期临床试验达到主要终点和次要终点。
OCARINA II 试验是一项随机、全球多中心 III 期临床研究,在 236 例复发性多发性硬化症(RMS)或原发性进展性多发性硬化症(PPMS)患者中评估奥瑞珠单抗(Ocrevus)皮下制剂与静脉输注的药代动力学、安全性、放射学和临床疗效。
主要终点是皮下注射后第 1 天至 12 周的血清曲线下面积 (AUC) 与静脉输注相比的非劣效性。次要终点包括奥瑞珠单抗的最大血清浓度(Cmax),8 周和 12 周时活跃的、钆增强的 T1 病变总数,12 周和 24 周时新发或扩大的 T2 病变,以及安全性和免疫原性结果。探索性终点包括患者报告的结果。
结果显示,通过 12 周的药代动力学测量,奥瑞珠单抗皮下注射的效果不逊于静脉输注(IV)。二者在 12 周内控制脑磁共振成像(MRI)病变活动方面也具有可比性。在安全性方面,与奥瑞珠单抗静脉注射一致。详细数据结果将在后续召开的医学会议上公布。
奥瑞珠单抗皮下注射剂型基于 Halozyme Therapeutics 公司的 ENHANZE 药物递送技术,将奥瑞珠单抗和组人透明质酸酶 PH20(rHuPH20)组成复方制剂,后者可局部暂时降解透明质酸,增加皮肤下组织的渗透性,为大分子提供进入空间,并使皮下制剂能够迅速分散和吸收到血液中。
与静脉注射相比,皮下注射剂型每年两次在 10 分钟内给药,减少患者给药时间,提升了患者依从性。此外,该药有可能在静脉注射能力有限或没有静脉注射基础设施的医疗中心使用。
奥瑞珠单抗是一款第二代 CD20 单抗,2017 年 3 月获 FDA 批准上市用于治疗 多发性硬化症(MS)。与同样获批 MS 的二代 CD20 单抗奥法妥木单抗相比,奥瑞珠单抗市场表现更突出,2022 全年销售额已达 63.33 亿美元,占据罗氏制药的销售额 TOP1 位置,也是同适应症最高市场份额占据者。2023 年 Q1 收入同比增速 14%,仍处于稳步增长中。
而罗氏开发的皮下注射剂型迎来好消息,有望为其带来更多市场空间。
多发性硬化症(MS)是罗氏在神经科学领域主攻的适应症之一,其布局的另一款同适应症产品也备受关注。
Fenebrutinib(GDC-0853/RG7845)是全球当前唯一跃进 III 期多发性硬化症(MS)研究的非共价 BTK 抑制剂。据 Insight 数据库显示,针对 MS,罗氏正在开展 FENhance、FENtrepid 两项 III 期注册临床试验,预计分别将于 2025 年、2026 年完成。
此外,针对 MS,罗氏另布局有 RG6035、RG6182 等产品当前处于早期研发阶段。
7 月 11 日,百济神州宣布已于 2023 年 7 月 10 日与诺华签署共同终止和释放协议,共同终止关于 TIGIT 单抗欧司珀利单抗的选择权协议,终止协议自签署日起立即生效。这项曾以超 28 亿美元总额刷新国内 License out 交易额榜单的合作宣告终结。百济将继续推进欧司珀利单抗与抗 PD-1 抗体替雷利珠单抗联合用于治疗 PD-L1 高表达且无致敏 EGFR 突变或 ALK 易位的一线局部晚期、不可切除或转移性非小细胞肺癌 (NSCLC) 患者的 3 期 AdvanTIG-302 试验的患者入组。此外,由于治疗方式发生变化,将停止 3 期 AdvanTIG 301 试验,这项试验用以比较欧司珀利单抗联合替雷利珠单抗与度伐利尤单抗治疗同步放化疗 (cCRT) 后 III 期不可切除 NSCLC 患者。
免责声明:本文仅作信息分享,不代表 Insight 立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
投稿:微信 insightxb;邮箱 insight@dxy.cn
Insight 数据库网页版等你体验










