最近有小伙伴反映收不到推送,因为公众号改了推送算法,现在需要加星标,多点赞、点在看,才能准时收到推送哦。
导语:中性粒细胞在肿瘤微环境(TME)中发挥关键作用;然而,它们在胶质母细胞瘤(GBM)中的功能被忽视且研究不足。对与GBM相关的中性粒细胞(GBMAN)亚群进行详细分析可能为GBM免疫疗法提供新的见解和机会。
北京墨因生物已经与国内50+知名医院的老师或名牌大学实验室合作(协和、哈工大、同济、哈医大等)。欢迎有生信分析需求的老师垂询,公共数据库数据挖掘或自测数据分析均可。

本研究通过单细胞RNA测序结合机器学习揭示了与胶质母细胞瘤相关的中性粒细胞异质性,并建立了一个VEGFA+中性粒细胞预后模型。文章发表在《Biology Direct》上,文章题目为:Large-scale bulk and single-cell RNA sequencing combined with machine learning reveals glioblastoma-associated neutrophil heterogeneity and establishes a VEGFA+ neutrophil prognostic model。本研究整合了一个大型单细胞转录组数据集,包括来自127个样本、66名患者的498,747个细胞(图1A)。在进行降维和聚类后,本研究使用详细的标记信息对细胞簇进行了注释,识别出15种不同的细胞类型,包括肿瘤相关中性粒细胞(TAN)、癌症相关成纤维细胞(CAF)、周细胞、内皮细胞、增殖型CD8+ T细胞、CD8+ T细胞、CD4+ T细胞、B细胞、单核细胞、增殖样MoTAM、MoTAM、Mg_TAM、肿瘤细胞、增殖样肿瘤细胞和少突胶质细胞(图1B)。没有特定标记表达的细胞被分类为未知细胞。然后本研究分离出TANs并进行了二次降维和聚类,识别出四种GBMAN亚型:MNDA+GBMAN、LGALS1+GBMAN、ADM+GBMAN和VEGFA+GBMAN(图1C)。每种亚型的特定标记表达如图1D所示。
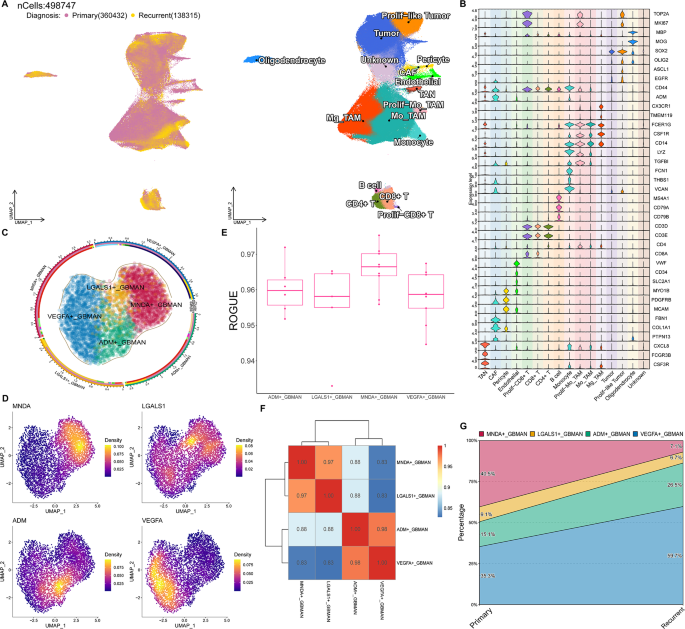
为了验证这些亚群的有效性,本研究评估了每个GBMAN亚型的纯度,发现所有四个亚型的ROGUE值均超过0.9(图1E),表明其具有高纯度和稳定性。相关性分析揭示,MNDA+GBMAN和LGALS1+GBMAN具有相似的特征,ADM+GBMAN和VEGFA+GBMAN也有相似的特征(图1F)。最后,对亚群比例的比较显示,在复发患者中,MNDA+GBMAN的比例显著减少,而VEGFA+GBMAN的比例显著增加(图1G)。这些发现表明,GBM中存在四种中性粒细胞亚型。
通过应用Palantir算法,本研究发现中性粒细胞从MNDA+GBMAN逐渐发展为VEGFA+GBMAN(图2A-B)。值得注意的是,本研究还发现ADM+GBMAN具有显著的分化潜力,表明在这一阶段中性粒细胞的分化发生了转变(图2C)。最后,使用Cytotrace2算法,本研究确认MNDA+GBMAN的干性评分随着其向VEGFA+GBMAN的分化逐渐降低(图2D),这一发现也得到了VECTOR算法的进一步证实。TANs可以采用两种表型:N1或N2。N2表型被认为是免疫抑制性的,并在促进肿瘤生长中起到作用。使用ssGSEA算法,本研究观察到VEGFA+GBMAN具有较高的N2评分(图2E)。为了阐明功能动态,本研究将具有不同表达模式的基因聚类为四个阶段,并进行了GO(BP/CC/MF)和京都基因组百科全书(KEGG)富集分析(图2F)。这些分析揭示了中性粒细胞最初参与防御和免疫反应,TNF通路被激活以发挥细胞毒效应。随着时间的推移,细胞迁移变得更加突出,受配体活性的驱动,最终出现了白细胞迁移特征,表现出明显的缺氧特征。
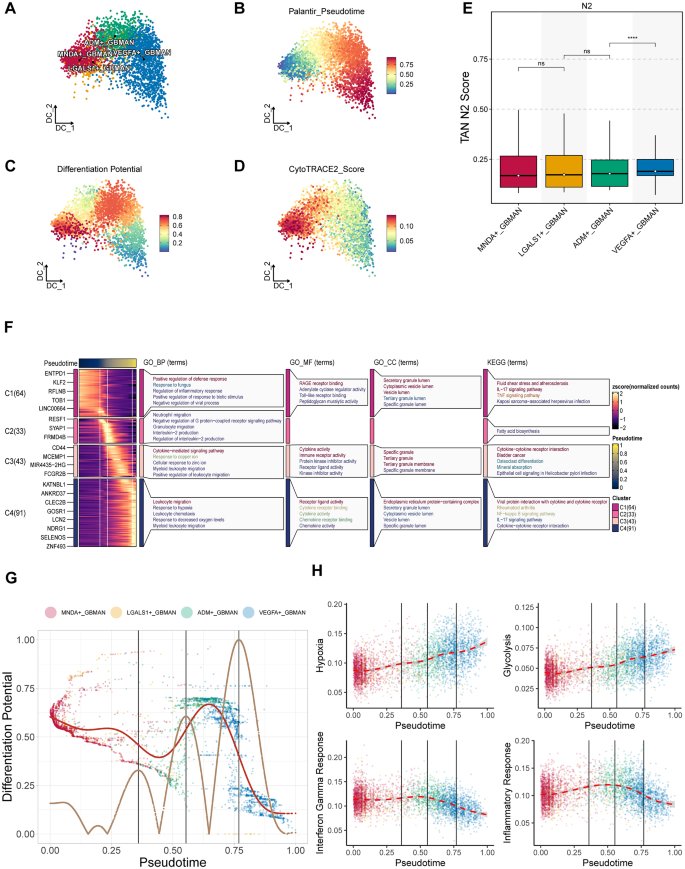
接着,本研究进行了一阶导数拟合,以得出一个曲线,展示了伪时间中分化潜力的变化。二阶导数分析确定了三个关键的伪时间点,这些点代表了中性粒细胞分化潜力的显著变化(图2G)。这三个关键点分别是:(1)快速分化的初期阶段,(2)由特定因素引起的分化变化,和(3)第二个加速分化阶段。这些发现表明,中性粒细胞的重编程在ADM+GBMAN阶段具有关键作用。最后,本研究使用ssGSEA通过标志基因集对每个细胞进行评分,并拟合数据以追踪变化(图2H)。本研究观察到,在逐渐增加的缺氧和糖酵解条件下,干扰素-γ和炎症反应最初在ADM+GBMAN阶段上升,之后迅速下降。这表明,GBMANs最初有助于促炎和抗肿瘤反应,但随着缺氧和糖酵解的加剧,它们最终被重编程为免疫抑制性的VEGFA+GBMAN。
细胞间通信和细胞因子介导的GBMAN亚群与其他细胞之间的转化利用中性粒细胞免疫因子反应数据,本研究进行了矩阵相似性分析,发现ADM+GBMAN的形成主要受到IL18和IL36a等因子的刺激,而VEGFA+GBMAN则主要受到IL1a、IL1b、IL18和TNFa的触发(图3A)。接下来,通过使用CellChat分析,本研究识别了细胞间通信模式,并比较了不同组之间通信强度(图3B)。结果表明,所有亚群与基质细胞(如CAF和内皮细胞)的相互作用更强,其次是肿瘤细胞和巨噬细胞。在从MNDA+GBMAN分化到VEGFA+GBMAN的过程中,本研究观察到,当TANs作为源细胞时,SELL-CD34/PODXL轴对内皮细胞的作用呈下降趋势,而VEGFA-VEGFR1/VEGFR2轴则逐渐增强。此外,HBEGF-EGFR轴在肿瘤细胞中显示出越来越强的激活作用。在其他髓系和淋巴细胞中,MIF-(CD74 + CXCR4)和MIF-(CD74 + CD44)轴在VEGFA+GBMAN中尤为显著。当TANs作为受体细胞时,来自多个细胞源的多个轴,如SPP1/FN1/COL1A1-CD44和ANXA1-FPR1/FPR2,在ADM+GBMAN中显著突出(图3C),这表明这些受体-配体对可能在推动VEGFA+GBMAN的转化和促进免疫抑制功能方面起着关键作用。
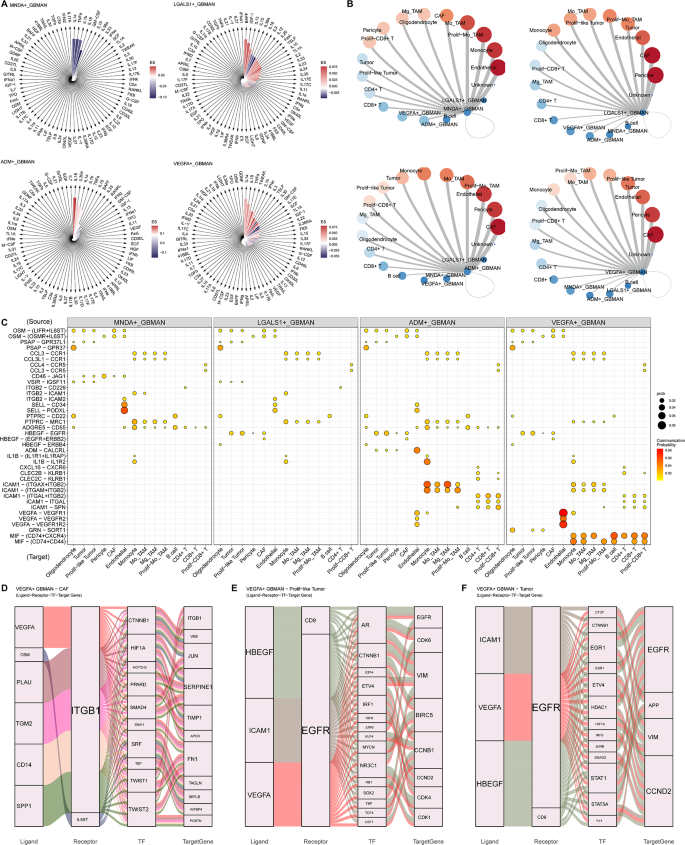
鉴于VEGFA+GBMAN具有强烈的免疫抑制特性,本研究进一步通过整合细胞间途径和细胞内子网络(配体-受体-转录因子-靶基因)(图3D-F)来研究其对其他细胞的影响。该分析结合了细胞类型特异性的基因表达、先前的网络信息和统计推断,揭示了VEGFA+GBMAN主要通过VEGFA、SPP1和PLAU等配体影响ITGB1。此相互作用影响HIF1A和TWIST1等转录因子,从而激活SERPINE1等靶基因,促进基质细胞的ECM重塑和血管生成,并通过肿瘤细胞促进免疫逃逸。此外,VEGFA和HBEGF等配体与EGFR相互作用,激活STAT1和ETV4等转录因子,进而激活CCND2等靶基因的表达,促进肿瘤细胞的生长和发育。
为了探讨不同GBMAN亚型的表观遗传特征,本研究首先评估了它们的基因组稳定性。本研究的研究结果显示,从MNDA+GBMAN到VEGFA+GBMAN,基因组不稳定性逐渐降低(图4A),表明抗肿瘤免疫反应的抑制逐渐增强,并且由于外部干预而发生功能性改变的可能性减少。识别能够诱导和维持这些细胞状态的关键基因调控网络(GRNs)可能为GBMAN的重编程提供新的策略。本研究采用SCENIC分析并对转录因子(TF)活性矩阵进行主成分分析(PCA)(图4B),结果显示MNDA+GBMAN与VEGFA+GBMAN之间有明显的区别。这表明四个GBMAN亚型之间转录调控特征逐渐发生分化。进一步分析识别了每个亚型的特定转录因子(图4C)。在原发组中,MNDA+GBMAN与CREB5和FOXP1相关,LGALS1+GBMAN与BHLHE41和CEBPE相关,ADM+GBMAN与SRF和STAT4相关,VEGFA+GBMAN与KLF10和SREBF1相关。在复发组中,MNDA+GBMAN与ZNF217和KLF7相关,LGALS1+GBMAN与RUNX3和POLE4相关,ADM+GBMAN与NFAT5和EGR2相关,VEGFA+GBMAN与ZNF432和ATF2相关。
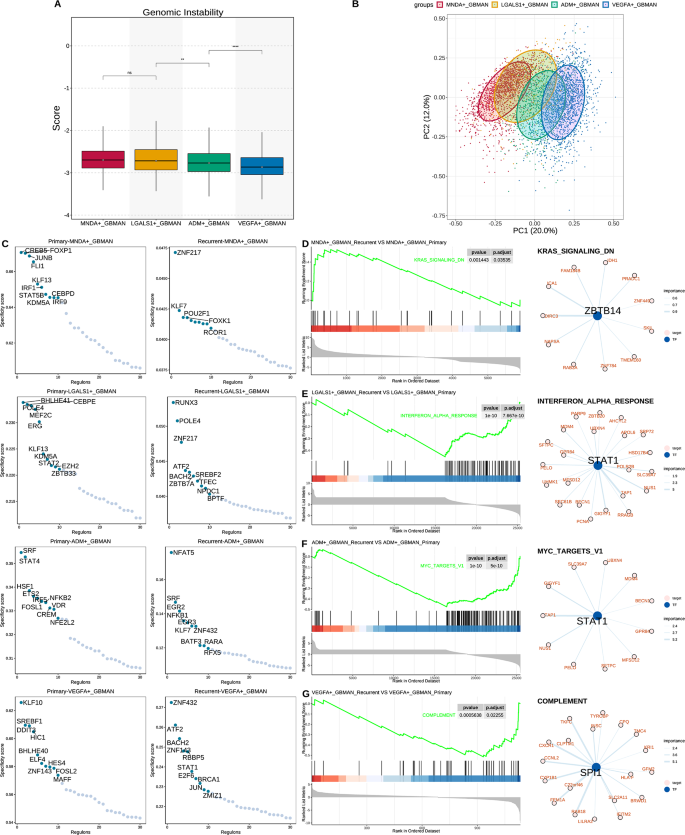
为了评估GRNs对GBMAN亚型在原发期和复发期途径变化的影响,本研究
对每个GBMAN亚型的差异表达基因进行了GSEA分析。然后,本研究基于转录因子-靶基因集分析了富集的基因(图4D-G)。本研究的分析显示,ZBTB14通过调控如DIRC3等基因上调了原发性MNDA+GBMAN中的KRAS信号通路。此外,STAT1通过调控SLC39A7等基因下调了复发性LGALS1+GBMAN中的干扰素-α反应通路,同时也通过调控TAP1下调了复发性ADM+GBMAN中的MYC靶基因V1通路。SPI1被发现通过靶向CXCR1和CCNL2等基因下调了复发性ADM+GBMAN中的补体通路。这些结果表明,原发性和复发性GBMAN之间的基因调控网络存在显著差异,并且四个亚型之间的网络也存在显著变化,每个网络都主宰着独特的功能。
这项研究利用大规模单细胞RNA测序(scRNA-seq)识别了不同的GBMAN亚群,分析了它们的发育轨迹、通信模式和调控网络。研究特别关注了VEGFA+GBMAN在促进免疫抑制肿瘤微环境(TME)中的作用,并绘制了GBMAN的蓝图。随后,采用机器学习技术开发了VNRS模型,最终构建了一个新的预后模型,该模型在现有的胶质母细胞瘤(GBM)风险模型中表现出较为优越的预测性能。VNRS不仅作为一个独立的预后因素来预测总生存期(OS),还在评估免疫疗法反应和化疗效果方面具有重要价值。本研究为理解中性粒细胞在GBM微环境中的作用提供了关键见解,并强调了GBMAN在其中未被充分重视的重要性。本研究揭示了这些亚群之间显著的转录差异,表明它们在TME中的潜在功能多样性。VNRS模型为指导个性化治疗、改善GBM患者的治疗效果提供了有前景的工具,并为新的免疫疗法策略的开发开辟了道路。
码字不易,欢迎读者分享或转发到朋友圈,任何公众号或其他媒体未经许可不得私自转载或抄袭。由于微信平台算法改版,公众号内容将不再以时间排序展示,建议设置“作图丫”公众号为星标,防止丢失。星标具体步骤为:(2)点击右上角的小点点,在弹出界面选择“设为星标”即可。