深度学习在影像学研究中的应用现状非常广泛,涉及到多个领域,如医学诊断、病变检测、影像分割和重建等。首先,深度学习技术已经被广泛应用于疾病的诊断和筛查。通过对医学影像数据进行分析,深度学习算法可以自动识别和分类可疑病灶,帮助医生进行更准确的评估和诊断。例如,在乳腺癌的早期筛查中,深度学习算法可以自动识别和分类可疑病灶,帮助医生进行更准确的评估和诊断。此外,深度学习还在肺部结节、脑部肿瘤等病变的检测和定位方面发挥了重要作用。通过训练深度学习模型,可以实现对不同病变类型的自动检测和定位,提高了检测效率,为治疗提供了重要的参考信息。
其次,深度学习技术在医学影像分割和重建方面也展现出强大的潜力。通过训练深度学习模型,可以实现对医学影像中的组织、器官或病变进行精确的分割和重建。这些信息对于手术规划、放射治疗以及疾病进展监测等方面具有重要意义。
然而,目前深度学习在医学影像研究中也存在一些挑战和问题。首先,深度学习模型对影像数目和质量有较高的要求,而临床上带有标记的医学影像数据难以获取,且数据不充足会影响预测的准确性和稳定性。因此,如何在只有少量有标签数据的情况下,采用弱监督、迁移学习以及多任务学习的思想,提高分类预测的准确度,将是持续的研究热点。其次,深度学习模型所学习的特征无法进行有效的解释,与临床需求中要求的可解释性还有一定的距离。因此,研究深度学习模型的可解释方法将是医学图像领域的研究热点。最后,如何提高模型预测的鲁棒性也是待解决的难点。现有深度学习模型多数仅针对单一数据集效果较好,无法在不训练的情况下,较好地预测其他数据集。
总的来说,深度学习在影像学研究中的应用已经取得了显著的进展,但仍存在一些挑战和问题需要解决。随着技术的不断发展和完善,相信深度学习在医学影像领域的应用将会越来越广泛,为医学诊断和治疗提供更多的支持和帮助。

文章期刊:
npj Digital Medicine是一本专注于数字医学领域的开放获取在线期刊,创刊于2018年。该期刊由自然出版集团(Nature Publishing Group)出版,致力于发表数字医学领域的高质量同行评议研究。作为一本跨学科期刊,npj Digital Medicine覆盖了数字医学的多个方面,包括数字和移动技术的临床应用和实施、虚拟医疗、人工智能和信息学的新应用等。其旨在通过结合新的数字和移动技术,推动卫生和医疗保健的创新和转型。
在决定稿件是否在范围内时,npj Digital Medicine强调四个标准:新颖性、临床相关性、科学严谨性和对数字医学领域的重要性。这意味着该期刊只接受具有创新性和实用性的研究论文,这些论文需要对数字医学领域的发展有重要的推动作用。根据最新的数据,npj Digital Medicine的影响因子为15.357,被收录于JCR分区中的Q1区,同时在中科院分区中也被列为一区。这表明该期刊在数字医学领域具有很高的学术水平和影响力。此外,npj Digital Medicine的出版周期为每年一期,每期都会发布最新的研究成果和进展。由于其开放获取的特性,该期刊的论文可以免费阅读和下载,这为广大学者和研究人员提供了便捷的获取渠道。
npj Digital Medicine机器学习领域文章的发表情况:
npj Digital Medicine是一个专注于数字医学领域的开放获取期刊,由自然出版集团(Nature Publishing Group)出版。该期刊主要发表使用数字技术、计算方法和机器学习等技术在医学领域的应用和研究成果。关于该期刊上发表的机器学习类杂志的现状,我可以提供以下信息:
1.增长趋势:随着数字技术和机器学习的快速发展,npj Digital Medicine 上发表的与机器学习相关的文章数量呈增长趋势。这是因为机器学习在医学诊断、治疗、预后预测等方面具有巨大的应用潜力。
2.研究范围:npj Digital Medicine 上的机器学习研究涵盖了多个医学领域,如医学影像分析、基因组学、病理学、药物研发等。这些研究利用机器学习算法对医学数据进行处理和分析,以提高诊断准确性、优化治疗方案等。
3.跨学科合作:许多在npj Digital Medicine上发表的机器学习研究都是跨学科合作的成果。这些合作涉及计算机科学、生物医学工程、生物信息学等多个领域,促进了机器学习在医学领域的应用和发展。
4.开放获取和影响力:npj Digital Medicine 采用开放获取模式,使得其发表的文章能够被更广泛地传播和引用。这有助于提高文章的影响力和可见度,促进学术交流和合作。
总之,npj Digital Medicine上的机器学习类杂志在数量和质量上都在不断提高,为医学领域的发展提供了有力支持。
文章阅读摘要:
本文利用深度学习技术,作者成功地从苏木精和伊红(H&E)染色的组织病理学图像中识别出50个复杂的组织形态学表型簇(HPCs)作为关键病理特征。进一步筛选出其中两个具有显著预后价值的表型簇,并结合Cox回归模型整合成新的病理特征指标——PathoSig。这一指标不仅显示出对总生存期和无病生存期的显著风险分层能力,还能成功识别可能受益于术后或术前放化疗的患者。在独立的多中心队列中验证了PathoSig的预测能力,其有效性得到了证实。PathoSig提供的预后信息超越了当前的TNM分期系统和分子分型,为临床决策提供了更全面的参考。这一研究成果展示了深度学习在组织病理学图像分析中的巨大潜力,有望为小细胞肺癌(SCLC)的预后预测和治疗反应评估提供新的有力工具。未来的研究方向包括扩大样本量以验证PathoSig的通用性和可靠性,以及结合其他组学数据来构建更全面的肿瘤画像,从而为精准医疗提供更强大的支持。
数据来源:
作者回顾性收集了来自两个医疗中心的380例手术切除和病理证实的SCLC标本,包括CHCAMS队列的286例和PUCH队列的94例。纳入标准包括病理诊断为SCLC、提供完整的临床和病理资料、有DFS(无进展生存期)和OS(总生存期)的随访数据以及可获得的肿瘤组织。DFS和OS分别定义为从初次手术到肿瘤复发、进展、死亡或无病患者的最后一次随访时间和从手术日期到死亡或最后一次随访的时间。这些队列的临床特征详见表1。
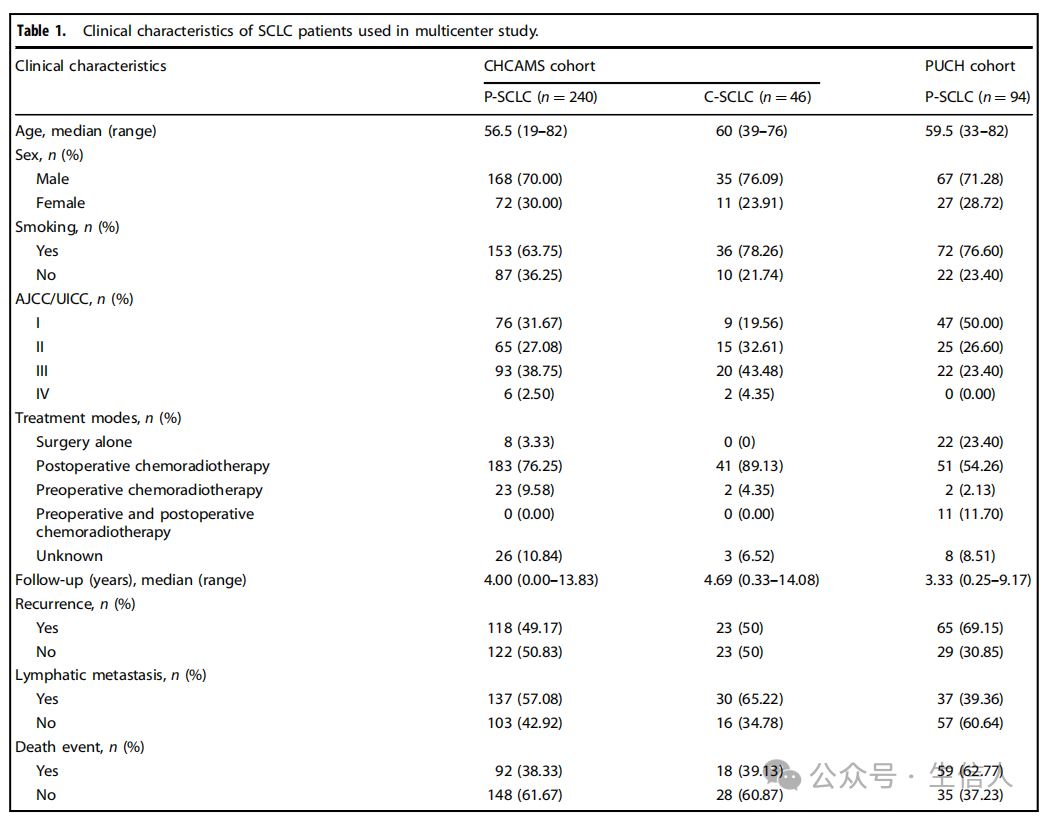
表1 多中心研究中SCLC患者的临床特征
PathoSig模型建立:
1. 研究背景与数据来源
·概述:描述了研究的背景和数据来源,包括回顾性收集的380例手术切除和病理证实的SCLC标本,来自两个独立医疗中心的数据。
·详细内容:从两个医疗中心(中国医学科学院肿瘤医院和北京大学肿瘤医院)收集了SCLC标本,提供了详细的纳入标准和临床特征。
2. 组织形态学特征的提取
·概述:介绍了使用对比聚类方法从H&E染色的组织病理图像中提取组织形态学特征的过程。
·详细内容:
描述了切片分割、过滤、聚类以及使用UMAP进行可视化的步骤,确定了50个块级组织形态学表型聚类(HPCs)作为特征。
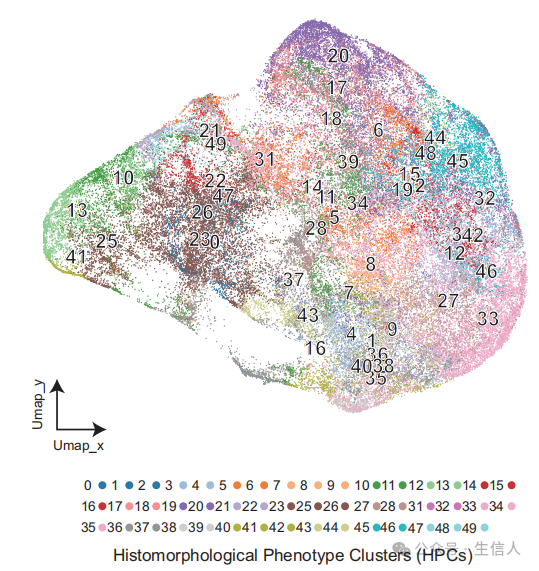
图1 对每个图像图层进行基于UMAP的实例级特征向量降维,然后将50个图层级别的组织病理学表型簇(HPCs)映射到UMAP图上
3. 组织形态学特征与生存期的关系
·概述:探讨了组织形态学特征与总体生存期(OS)之间的关系,并确定了与OS显著相关的特征。
·详细内容:使用单变量Cox回归分析评估了特征与OS的关系,确定了四个与OS显著相关的特征,并进一步通过多变量分析评估了它们的独立预测能力。
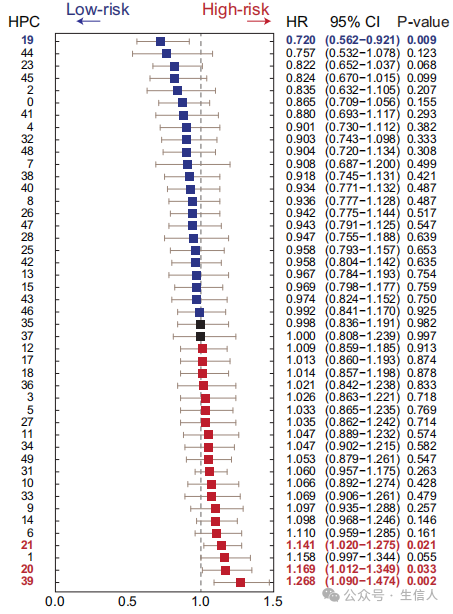
图2 森林图显示每个组织形态特征的单变量Cox回归分析的风险比(95%置信区间)
4. PathoSig综合指数的建立与应用
·概述:介绍了PathoSig综合指数的建立过程及其在测试数据集中的应用。
·详细内容:建立了结合两个独立预测特征的综合指数PathoSig,用于预测H&E染色玻片的风险。在测试数据集中验证了其预测OS的能力,并将患者分为不同风险组,展示了其在实际应用中的价值。
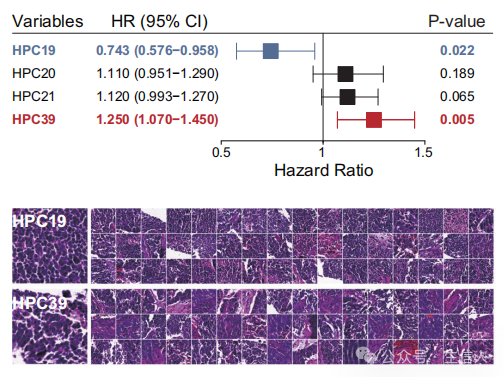
图4 森林图显示四种预后组织形态学特征(HPC19、HPC20、HPC21和HPC39)的多变量Cox回归分析的风险比(95%置信区间)。e HPC19和HPC39组织病理表型簇的可视化
5. 研究结果与讨论
·概述:总结了研究的主要发现,并讨论了其在SCLC患者预后预测和个性化治疗中的潜在应用。
·详细内容:强调了组织形态学特征在SCLC预后预测中的重要性,以及PathoSig在风险分层和个性化治疗中的潜在价值。同时,也指出了进一步研究的方向和潜在限制。
验证PathoSig的预后意义:
1. 内部独立队列的验证
·研究目的:验证PathoSig在内部独立队列中的预后意义。
·研究方法:使用两个未在发现和模型训练阶段使用的内部独立队列(验证-1和验证-2)进行测试。应用相同的PathoSig模型和截断标准,根据组织形态学表型将患者分为三个风险组(低、中、高)。
·研究结果:观察到三个风险组的生存时间在两个内部独立队列中均有显著的分层。高危患者的OS低于低危患者,中危患者的OS介于两者之间。
2. 外部队列的验证
·研究目的:在外部队列中进一步评估PathoSig的预后价值。·研究方法:在PUCH队列中应用PathoSig,将患者分为低、中、高风险组。
·研究结果:PathoSig成功地将患者分为风险组,且OS差异显著。
3. 多变量Cox回归分析
·研究目的:检验PathoSig是否具有独立的预后价值。
·研究方法:在三个独立的验证队列中对PathoSig进行多变量Cox回归分析,纳入不同的临床特征(如性别、年龄、吸烟史和分期)作为协变量。
·研究结果:即使调整了各种临床病理特征,由PathoSig识别的高危组仍与不良OS显著相关。这表明PathoSig是预测SCLC患者OS的可靠且独立的预后因素。
总结:通过在两个内部独立队列和外部队列中的验证,以及多变量Cox回归分析,本研究证实了PathoSig在预测SCLC患者OS方面的可靠性和独立性。这一综合指数有望为SCLC患者的风险分层和预后预测提供新的手段,帮助医生制定更个性化的治疗方案。同时,本研究也强调了组织形态学特征在癌症预后预测中的重要性,为未来基于组织形态学特征的研究提供了参考。
图5 独立队列中病理特征的性能验证。Kaplan-Meier分析验证-1队列(a)、验证-2队列(b)和验证-3队列(c)中低、中、高风险组的总生存率
PathoSig对放化疗临床疗效的预测价值分析:
1. DFS持续时间与PathoSig风险组的关系
·研究方法:通过分析四个队列(发现队列、验证-1队列、验证-2队列和验证-3队列)中术后接受放化疗的患者的DFS持续时间。
·研究结果:在所有四个队列中,被PathoSig分类为高危组的患者DFS持续时间显著缩短,与低危组和中危组相比有显著差异。这一趋势在所有队列中均保持一致,证明了PathoSig在预测DFS方面的稳定性和可靠性。
2. 疾病复发率与PathoSig风险组的关系
·研究方法:比较四个队列中不同PathoSig风险组的疾病复发率。
·研究结果:在所有四个队列中,高危组的复发率始终较高,与低危组和中危组相比有明显差异。这一结果进一步证实了PathoSig在预测疾病复发风险方面的价值。
3. PathoSig对DFS的独立预后价值
·研究方法:通过多因素Cox分析,调整各种临床特征后,评估PathoSig对DFS的独立预后价值。
·研究结果:即使在调整了各种临床特征后,PathoSig对DFS的独立预后价值仍然显著,表明其在预测DFS方面的独立性和可靠性。
4. 术前接受放化疗的SCLC患者的DFS与PathoSig的关系
·研究方法:由于每个队列患者数量较少,将四个队列合并进行进一步分析,比较术前接受放化疗的SCLC患者的DFS与PathoSig风险组的关系。
·研究结果:虽然可能由于样本量的限制未达到统计学意义,但高风险组的DFS持续时间较短,且复发风险增加,提示PathoSig在术前接受放化疗的SCLC患者中也有一定的预测价值。
总结:通过对DFS持续时间和疾病复发率的分析,本研究证实了PathoSig在预测放化疗临床疗效方面的价值。无论是在术后还是术前接受放化疗的SCLC患者中,PathoSig都能有效地将患者分为不同风险组,并预测其DFS和复发风险。这为临床医生制定个性化的治疗方案提供了重要参考。同时,本研究也强调了组织形态学特征在预测癌症患者临床疗效方面的重要性。
图6 病理特征与术后或术前放化疗治疗效果之间的关系。a不同队列中低、中、高风险组术后放化疗患者无病生存的Kaplan-Meier分析。b不同队列低、中、高危组术后放化疗患者的复发率和不复发率百分比直方图。c在联合队列中,低、中、高危人群术前放化疗患者无病生存的Kaplan-Meier分析。d在联合队列中,低、中、高危组接受术前放化疗患者的复发率和不复发率的百分比直方图
PathoSig在不同临床分期和转移状态SCLC患者中的预后价值评估:
1. 早期和晚期SCLC患者的分层分析
·研究方法:为了评估PathoSig是否能在同一临床分期内提供更好的生存预测,我们分别对P-SCLC和C-SCLC患者的早期(I/II期)和晚期(III/IV期)SCLC进行了分层分析。
·研究结果:
·在早期患者中,PathoSig成功地将患者分为高危、低危和中危组。在P-SCLC和C-SCLC中,高危组和低危组在OS和DFS上存在明显差异,显示出PathoSig在早期患者中的预后价值。
·在晚期患者中,PathoSig同样显示出显著的预后价值。无论是在P-SCLC还是C-SCLC中,高危患者与低危患者在OS和DFS上均存在显著差异。
2. 有无转移患者的分层分析
·研究方法:为了进一步研究PathoSig在不同转移状态患者中的预后价值,我们对有或无转移的患者进行了分层分析。
·研究结果:
·在非转移性患者亚组中,与P-SCLC和C-SCLC中的中危和低危患者相比,高风险患者表现出更短的OS和DFS,进一步证实了PathoSig在非转移性患者中的预后意义。
·在转移性患者亚组中,与P-SCLC和C-SCLC中的中危和低危患者相比,高风险患者的OS和DFS也较差,表明PathoSig在转移性患者中同样具有预后价值。
总结:通过分层分析,本研究表明PathoSig在不同临床分期和转移状态的SCLC患者中均显示出显著的预后价值。即使在相同的临床分期内,PathoSig也能有效地将患者分为不同风险组,并预测其OS和DFS。这为当前的SCLC分期系统提供了额外的预后信息,有助于医生制定更为精准的治疗策略。同时,本研究也进一步强调了组织形态学特征在癌症预后预测中的重要性。
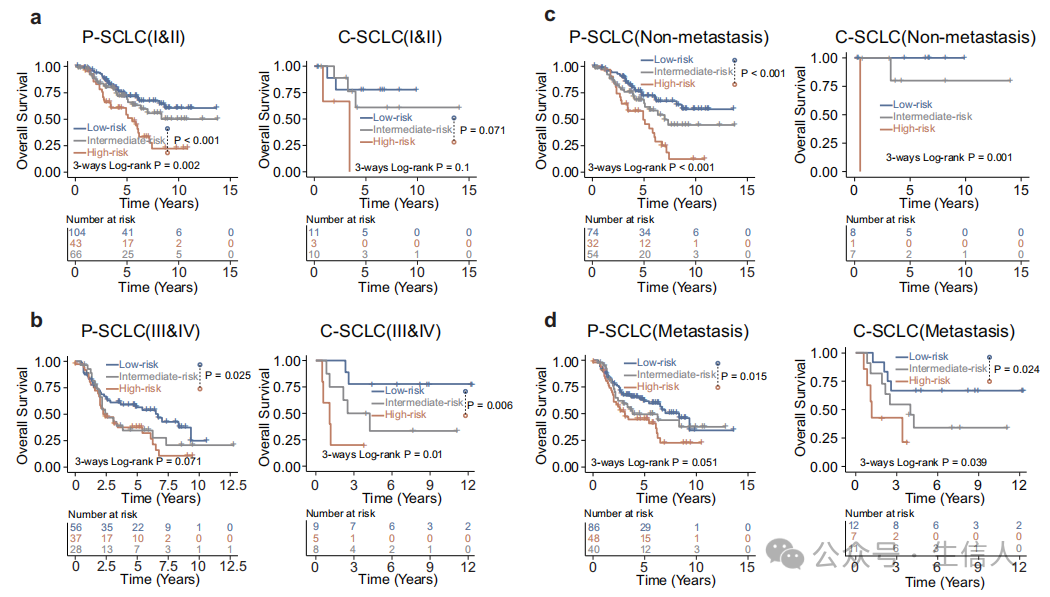
图7 病理特征在当前分期系统中的性能评价。a P-SCLC或C-SCLC的低、中、高风险组的Kaplan-Meier总生存率分析。b对iii期和iv期P-SCLC或C-SCLC患者的低、中、高风险组的总生存率进行Kaplan-Meier分析。c低、中、高风险组非转移性淋巴结患者的总生存率Kaplan-Meier分析。d转移性淋巴结患者低、中、高风险组总生存率Kaplan-Meier分析
PathoSig与SCLC的主要分子亚型之间的关系研究
1. SCLC的主要分子亚型与患者风险组的关系
·研究方法:通过免疫组化方法检测了286例SCLC患者的四种主要转录因子(ASCL1、NEUROD1、POU2F3和YAP1)的蛋白表达,并根据这些转录因子的显性表达将这些患者分为四种分子亚型。
·研究结果:在SCLC-A亚型中,50.9%的患者被PathoSig划分为低风险组,而高风险组中SCLC-N亚型患者的比例最高,达到40.0%。这一结果提示了不同分子亚型与PathoSig风险组之间存在一定的关联。
2. 结合分子亚型与PathoSig的生存风险分层分析
·研究方法:将四种分子亚型与PathoSig结合,对患者进行生存风险分层分析。
·研究结果:即使是具有相同分子亚型的患者,由于被分为不同的PathoSig风险组,其OS和DFS结果也存在显著差异。例如,SCLC-A亚型中,不同风险组的log-rank p值为0.038和0.095;SCLC-N亚型中,不同风险组的p值均小于0.001。这一结果进一步证实了PathoSig在预后预测中的价值,并且它能够为分子亚型提供额外的预后信息。
总结:通过本研究,我们发现PathoSig能够进一步将不同分子亚型的患者进行分层,即使在分子亚型相同的情况下,由于PathoSig的不同风险组划分,患者的OS和DFS结果也存在显著差异。这一发现为SCLC的预后预测提供了新的视角和方法,有助于医生为患者制定更为精准的治疗策略。同时,本研究也强调了综合应用多种预后指标在癌症患者管理中的重要性。
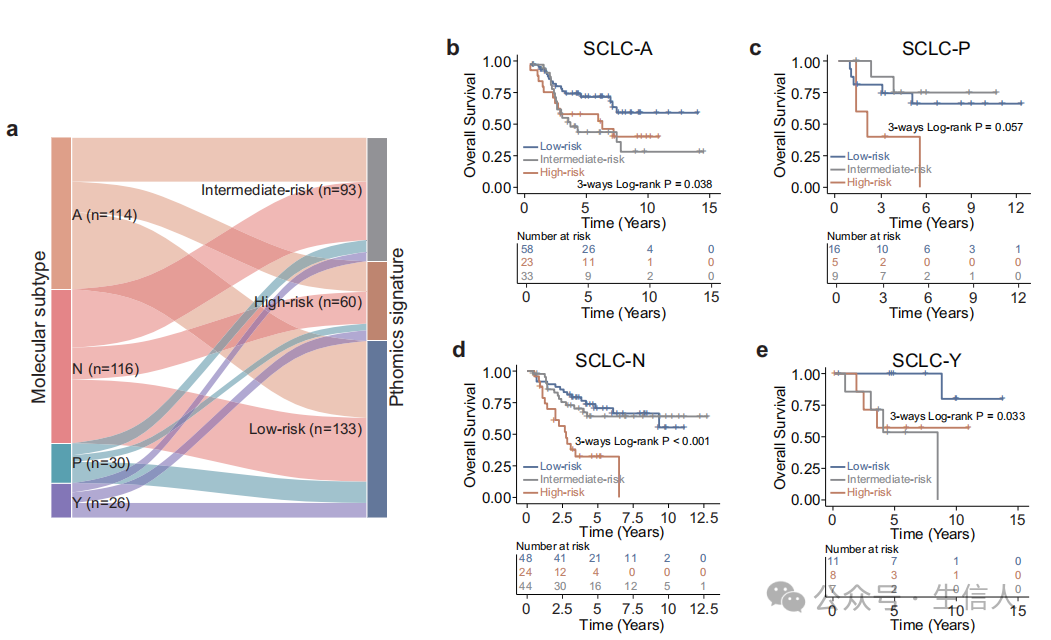
图8 基于转录因子定义的分子亚型(SCLC-A、SCLC-N、SCLC-P和SCLC-Y)的病理特征分层分析。根据病理特征显示分子亚型分布的冲积图。Kaplan-Meier分析了SCLC-A (b)、SCLC-P (c)、SCLC-N (d)和SCLC-Y (e)患者低、中、高风险组的总生存率
总结:
机器学习与医学影像学在SCLC预后预测及治疗决策中的融合应用
本文主要探讨了SCLC(小细胞肺癌)在预后预测和治疗决策方面所面临的挑战,并详细描述了如何利用机器学习与医学影像学的结合来解决这些问题。其中,PathoSig作为一种基于深度学习的算法,在H&E染色组织病理学图像上的应用,为SCLC的预后预测开辟了新的道路。
1. SCLC面临的挑战与机器学习的介入
SCLC通常在晚期才被诊断,这使得手术干预变得不太可行。此外,由于临床病理组织样本的有限可用性,对SCLC的深入研究受到了限制。传统的预后预测方法往往依赖于活检组织和分子实验,但这些方法既耗时又可能受到人为采样的影响。为了解决这些问题,机器学习被引入进来。通过训练大量的数据,机器学习算法能够从复杂的组织图像中提取出有意义的特征,为预后预测和治疗反应评估提供更为准确和客观的依据。
2. PathoSig的开发与应用
PathoSig是一种基于深度学习的算法,它利用自监督学习和社区检测来表示组织形态学表型。与传统的监督学习不同,自监督学习不需要人工标记或描绘目标区域,从而减少了人为采样带来的潜在偏差,并节省了大量的时间。PathoSig通过将载玻片划分为多个不重叠的马赛克状区域,提取出细胞排列和组织纹理特征,为预后预测和治疗反应评估提供了更为全面的信息。在两个医疗中心的队列中,PathoSig的有效性得到了验证,证明了其在预后预测方面的强大价值。
3. PathoSig与分子亚型的比较
虽然基于转录因子的分子亚型在SCLC的预后预测中也有一定的作用,但PathoSig提供了更为全面的预后信息。这意味着,即使患者具有相同的分子亚型,由于PathoSig的不同风险组划分,他们的OS和DFS结果也可能存在显著差异。这一发现为SCLC的风险分层和治疗决策提供了新的视角和方法。
4. PathoSig的临床应用潜力
PathoSig不仅能够预测患者的预后,还能够评估患者对治疗的反应。通过考虑DFS和疾病复发率等重要指标,PathoSig为医生提供了更为准确和客观的信息,帮助他们制定更为精准的治疗策略。此外,PathoSig的应用还可以帮助医生识别出那些高风险的患者,从而为他们提供更为有效的补充治疗计划,以提高DFS和降低复发率。
综上所述,机器学习与医学影像学的结合为SCLC的预后预测和治疗决策提供了新的思路和方法。PathoSig作为一种基于深度学习的算法,在SCLC的预后预测和治疗反应评估中显示出了巨大的潜力。随着技术的不断进步和应用范围的不断扩大,相信未来会有更多的机器学习算法和医学影像学技术被引入到肺癌的研究和临床实践中,为患者的治疗和生活质量带来更大的改善。
小编总结:
机器学习、人工智能(AI)和大型语言模型在医学影像学领域的应用与发展前景非常广阔。这些技术已经在这个领域产生了显著的影响,并且随着技术的不断进步,它们的应用范围和深度也在不断扩大。首先,机器学习在医学影像学中的应用主要体现在图像识别、病灶检测、定量标注、诊断等方面。通过训练大量的医学影像数据,机器学习算法可以自动识别出图像中的异常区域,如肿瘤、炎症等,从而为医生提供更为准确和客观的诊断依据。此外,机器学习还可以用于疾病的预测和风险评估,通过分析患者的医学影像数据和其他相关信息,预测疾病的发展趋势和患病风险,为医生制定更为精准的治疗方案提供依据。
AI在医学影像学中的应用已经涵盖了多个方面,如CT和MRI影像分析、乳腺X光检查、超声和心脏影像分析、疾病预测等。AI技术可以通过自动识别和分析医学影像数据,帮助医生快速准确地诊断疾病,提高诊断的准确性和效率。此外,AI还可以用于医学影像数据的处理和分析,如图像分割、病灶定量分析等,从而为医生提供更为全面和详细的信息。
大型语言模型如GPT-3和GPT-4等,在医学影像学领域也具有广阔的应用前景。这些模型可以用于医学文献和病历的处理和分析,帮助医生和研究人员快速获取相关信息,提高工作效率。此外,大型语言模型还可以用于医学影像数据的自然语言描述和解释,为医生和患者提供更为直观和易于理解的信息。
总的来说,机器学习、AI和大型语言模型在医学影像学领域的应用与发展前景非常广阔。随着技术的不断进步和应用范围的不断扩大,这些技术将会在医学影像诊断、疾病预测、治疗决策等方面发挥越来越重要的作用,为患者提供更好的医疗服务。同时,也需要注意到这些技术所带来的挑战和风险,如数据隐私和安全、算法偏见和歧视等问题,需要在应用过程中加以解决和防范。
更贴合临床的生信分析定制

文章转载请联系 | 15510012760(微信)