过去十年中,在各种先进技术的推动下,核医学成像技术取得了重大进步。核医学医生现在可以访问高维和多模态图像,以及有关肿瘤生物学和遗传特征的大量定量数据。在精准医学时代,提高图像质量、利用这些数据和提取有意义信息的能力是肿瘤学领域的当代挑战。
在核医学领域,AI对PET具有变革性的影响。AI和PET成像之间日益增长的协同作用有望彻底改变诊断、提高准确性并扩大临床应用。与其他AI技术相比,深度学习已成为关键参与者,可在广泛的任务中找到应用,包括成像采集和质量改进以及临床活动。然而,重要的是要承认AI涵盖了深度学习之外更广泛的技术,例如经典机器学习、强化学习和混合AI模型,并广泛应用于PET图像分割、检测和分类、量化、治疗计划、剂量测定和影像组学/影像基因组学与肿瘤生物学特征相结合等核医学具体场景。
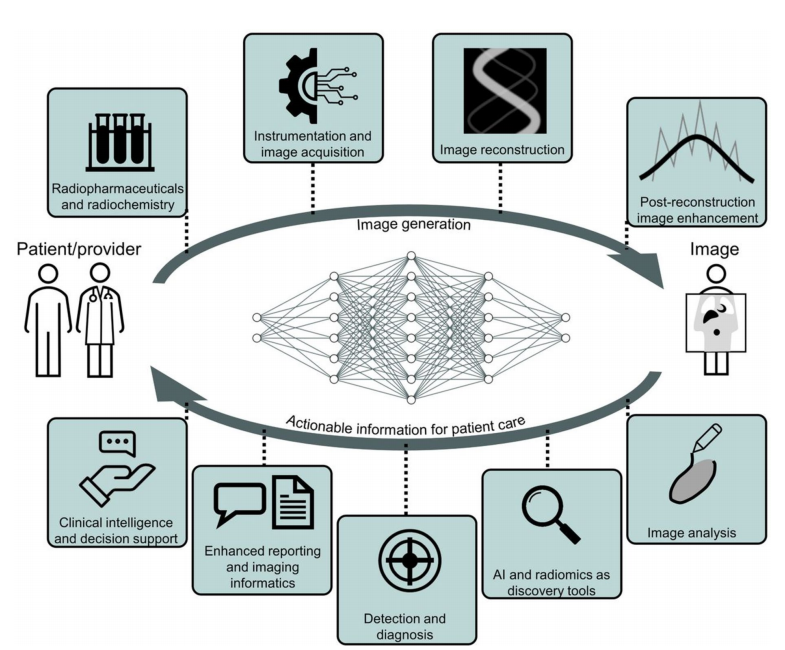
人工智能在核医学中的关键应用
AI算法的影响始于PET扫描仪,即PET图像采集的关键任务,包括事件定位、通过飞行时间估计和散射校正进行降噪。优化PET图像生成的这三个不同方面可以显著提高整体图像质量,从而产生提高病变可检测性的切实后果。
从历史上看,使用模拟脉冲处理电子设备和像素化晶体,使用简单的信号处理方法来计算每个探测器波形的拾取时间。随着快速波形数字化仪的出现,深度学习方法已成为改进闪烁体伽马检测、预测光子飞行时间(TOF)和提高符合时间分辨率的基础。人工智能驱动的技术对于将整体闪烁体晶体引入临床应用也至关重要,由于其降低的生产成本、良好的空间分辨率和相互作用深度估计,它吸引了核医学影像界的兴趣。采用实时算法来提高空间分辨率并使其可与像素化晶体相媲美,这对基于整体的PET探测器来说是一个挑战。为了解决复杂的非线性任务,例如确定光子相互作用位置,深度学习神经网络算法一直是整体晶体中事件时间戳的基础,引起了人们对其在完整PET扫描仪中使用所必需的实时硬件实现的关注。由于深度学习神经网络算法的实现,基于单片的设备现在有可能达到超越最先进水平的性能水平。
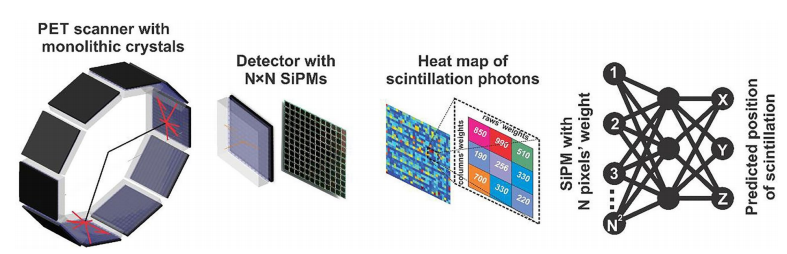
添加有关沿响应线(LOR)的正电子湮灭位置信息的能力是重建过程中的一个重要参数,从而提高信噪比和病变可检测性。已经实现了深度CNN,以直接从一对数字化检测器波形中估计重合事件的TOF。CNN能够学习输入数据的复杂表示,使其适合从被多个复杂随机过程混淆的波形中进行TOF估计。由于所有的时间信息都包含在探测器波形的最初几纳秒内,因此卷积神经网络(CNN)算法巧妙地在信号的上升沿开发而成,无需存储整个波形来进行TOF估计。到目前为止,仿真研究表明,对于带有单片PET检测器的数字化仪,使用3D-CNN可以实现卓越的时间分辨率,与传统的前沿鉴别方法相比,前几个时间戳的平均值提高了26%。
影响图像质量的另一个不确定性来源是随机散射的光子,它会增加低频背景并引入严重的伪影。人工智能方法并不能完全取代这项任务中的传统方法,例如光子散射的物理模型,而是代表了寻找函数映射关系的辅助手段,在很大程度上取决于模型结构、数据范围和训练过程。神经网络(NN)方法已经被开发出来,以解决LOR评估中光子散射产生的三重重合问题。该方法通过预处理能量和位置测量值,然后进行NN判别来计算符合内的LOR。NN方法的结果显示非常好的LOR恢复率(75%),通过在传统的360-660keV能量窗口和125
keV的单一能量阈值内结合三重符合,总体灵敏度提高了55%(实际扫描仪条件)。与仅光峰图像相比,该方法表现出可接受的、有限的分辨率下降,几乎没有对比度损失。
PET扫描仪不会直接在图像空间中生成数据,但它们需要重建算法来获得断层扫描表示。这是一个可逆问题,但缺乏精确的解决方案,并且只能使用迭代算法找到闭式近似,迭代算法的计算成本很高,并且可能仍包括前向运算符中的建模误差。基于DL的方法已被用于解决这些限制,方法是用直接从数据中学习的参数替换传统方法中不确定的用户定义变量。
PET图像采集时间延长会导致器官和病变因不可避免地呼吸运动,导致模糊,从而降低图像质量并降低空间分辨率。由于PET空间分辨率的固有局限性,准确评估受呼吸和心脏运动影响的区域也具有挑战性。这在临床环境中至关重要,例如检测小肺结节、量化心肌血流和评估心肌信号强度的细微变化(即血管移植手术后疑似心内膜炎或主动脉根部并发症)。数据驱动的门控方法通过对这些典型的心脏和呼吸运动进行建模和补偿,提供了可行的解决方案,从而能够改进图像重建。
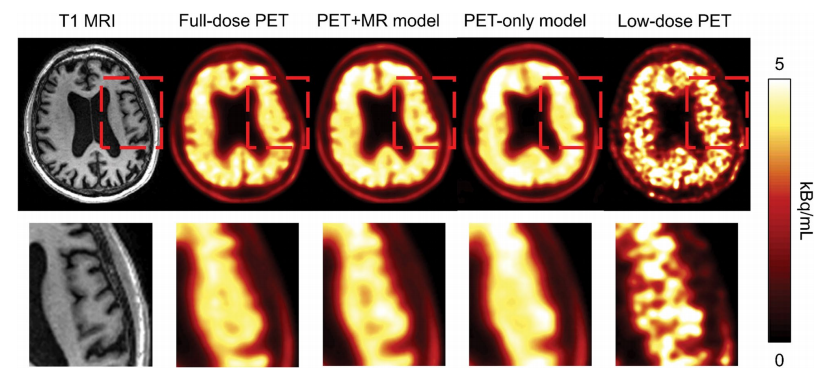
使用阿尔茨海默病患者的低剂量[18F]Florbetaben
PET图像深度学习模型进行图像增强的示例
使用ROI分割的图像预处理技术是多项临床任务的关键步骤,包括定量分析、治疗计划、反应评估、病变分类和高级图像分析(影像组学)。已经开发了几种方法来执行半自动,这仍然需要手动调整分割区域,并完全自动分割ROI。AI将逐渐取代手动分割的做法,手动分割通常很耗时,存在可变性以及低可重复性。最常见的分割算法包括:① 基于阈值的算法;② 基于梯度的算法;③ 基于区域生长的算法;④ 基于统计分析的算法;⑤ 通过DL算法基于AI。
基于DL的分割算法已成功应用于不同放射性药物和不同临床环境中的PET图像,从肿瘤学到心脏和脑成像。此外,通过结合分别对CT图像和PET图像进行的分割算法,可以提高单独基于CT或PET图像的分割模型的性能,从而充分利用混合成像的潜力。
在医学图像分析中,委托给AI的最复杂的任务是肿瘤病变的检测和分类。肺结节表征是计算机辅助系统最有前途的应用之一。计算机辅助检测和计算机辅助诊断系统,前者仅识别和定位可疑的改变,而后者还定义了它们的特征并将其归类为良性/恶性发现。虽然这些系统节省了图像解读的时间,但它们并不是为了取代医生,医生总是需要专业的眼睛来确认算法生成的结果。AI算法将提供预先筛选的图像和预先识别的关键特征,通过减少人为错误的数量、观察者之间的差异和平均报告时间,从而提高有效性和效率。计算机辅助系统可以使用ML或DL算法,具有有监督、半监督和无监督方法。该工作流程包括抑制不需要的噪声的预处理阶段、ROI的分割、特征提取和有意义特征的选择以及病变分类。
定量是诊断和治疗目的的重要生物标志物。在肿瘤学中,来自[18F]FDG
PET/CT的最常用半定量参数反映了基于单个体素SUV或基于体积(MTV和TLG)的代谢。半定量参数为病变特征、预后分层、疾病严重程度评估和治疗反应提供相关信息,指导临床医生进行患者管理。然而,在某些情况下,必须分割许多病灶才能获得这些数据,并且这项任务可能具有挑战性且耗时。DL算法已应用于全身图像,以分割多个病灶并快速自动提取相关的半定量参数。目前已经开发了几种CNN模型来分割病理病变,丢弃生理摄取区域并完全自动计算TMTV。这些架构可能为临床医生提供一个高通量平台,以高效、准确地进行半定量分析。
巨大的技术进步促进了先进放射治疗技术的发展,这些技术需要高度准确地定义目标肿瘤体积,以最大限度地减少对周围处于危险中的健康组织和器官的辐射剂量,完全符合精准医学的现代愿景。目标体积的描绘(GTV)目前使用多模式方法进行。从这个角度来看,代谢数据为形态学成像提供了补充信息,确定了容易受到放射抗性机制影响的最具侵袭性的肿瘤区域。剂量绘制方法需要向代谢活跃的肿瘤区域(定义为 “生物靶体积” )提供更高剂量的辐射,以改善疾病控制和生存。在临床实践中,PET/CT图像上的GTV描绘是通过基于阈值的半自动系统进行的,该系统检测具有高代谢的肿瘤区域,随后由医生进行视觉调整。
在治疗环境中,根据优化原则预测个体放射性药物剂量测定至关重要。目前,某些放射配体疗法仍然以固定剂量给药,治疗前成像仅用于选择表达治疗靶点的候选药物。然而,随着用于治疗的放射性药物的不断发展,范式正在发生根本性的转变。可以采用不同方法在平面或三维图像上进行全身吸收剂量定量。蒙特卡洛模拟克服了患者不同解剖特征的限制,但计算负担很高。此外,治疗前剂量估计涉及几个技术问题,需要多次动态全身扫描以推断药代动力学数据,目前不适合常规临床实践。DL算法用于从PET和CT生成基于体素的个体剂量测定图,效果极佳。
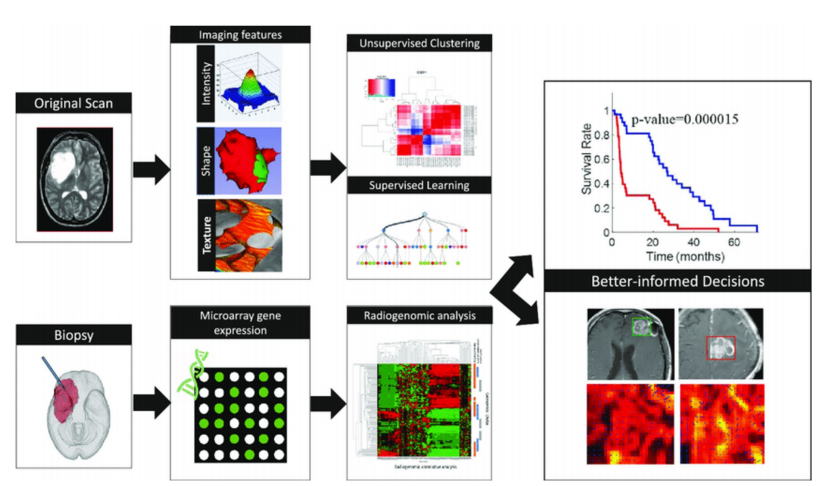
在过去的十年中,关于使用影像组学技术进行高级图像分析及其在不久的将来对临床常规的适用性,一直存在很多争论。影像组学已迅速尝试在视觉图像描述符和生物学/临床终点之间建立关系。影像组学涉及从反映器官、组织和肿瘤生物学特征的医学图像中高通量提取高维定量特征,以增加决策支持模型在结果预测和个体化患者管理方面的能力。个体化医疗是一个雄心勃勃的目标,它依赖于融合来自临床、影像学、基因组和其他组学数据的多学科数据。基因组学的进步导致了全基因组的测序,并为疾病易感性和癌症发展提供了有价值的见解。放射基因组学是一个相对较新的科学领域,旨在发现新的非侵入性生物标志物,并弥合基因组学和影像组学之间的差距。
虽然将人工智能整合到核医学中前景广阔,但必须认识并解决某些限制和挑战。开发强大而健壮的AI算法的最大限制之一围绕着可用于训练的数据的质量和数量。AI驱动的工具向临床工作流程的过渡可能会受到数据可用性、可访问性和互作性受限的阻碍。对于罕见癌症或特定患者群体尤其如此,但也包括医疗中心之间在成像方案、设备和放射性药物方面的数据质量差异。有几种策略可以帮助减轻数据不足的局限性,包括数据增强、迁移学习、合成数据生成和一次性学习。另一种方法是在不同机构之间共享数据。然而,数据互作性不足会对AI预测的准确性产生重大影响,因此应采用参考模型来建立可靠的数据。最小化测量不确定性、实现数据识别和标准化现有数据以用于研究目的的方法对于数据集成和增强核医学中的AI应用至关重要。通过利用大量学习数据的可用性(开放库等),已经开发了几种开源和专有软件工具。然而,图像解释软件与临床实践的集成受到开发时间长和监管审批严格要求的限制。因此,大多数算法目前都作为研究工具分发。要提供循证数据并确定将AI整合到临床实践中的真正影响,还有很长的路要走。
Artesani
A, Bruno A, Gelardi F, Chiti A. Empowering PET: harnessing deep
learning for improved clinical insight. Eur Radiol Exp. 2024;8(1):17.
Published 2024 Feb 7. doi:10.1186/s41747-023-00413-1