
动脉网获悉,2020年7月3日,北京推想科技有限公司旗下的肺部AI产品成功通过FDA审批。这是FDA批准的全美第一个应用深度学习算法的肺部辅助检测软件,医疗AI企业出海之旅有了实质性的突破。

为了深入了解FDA审批情况,动脉网联系到了推想科技负责审评审批的人员,这家公司的申请流程之中,我们或许能获取其中的经验,推动更多AI产品审批发展。
从2018年开始,我们便开始频繁议论中国人工智能影像医疗企业的海外市场。事实上,深耕国内同时远征海外的AI企业并不在少数,但无论是在哪里,他们都会面临一个同样的医疗器械认证问题。这里的困难在于,许多AI企业并没有相关的审批经验。
就美国而言,FDA与国内的NMPA拥有相似之处,但两者在监管体系、审批路径与审批时限上存在较大不同。
具体来看,中国NMPA和美国FDA都是基于风险对医疗器械进行审查和监管,NMPA将医疗器械分为一类、二类、三类,FDA将医疗器械分为Ⅰ、Ⅱ、Ⅲ类。
针对I类医疗器械,企业向FDA递交相关资料后,FDA只进行公告,不会给企业颁发相关证件。针对II和 III类医疗器械,企业必须递交510k或PMA,FDA在公告的同时,会给企业以正式的市场准入批准函件(Clearance),此后企业便可以在美国市场销售产品。FDA申请过程中是否到企业进行现场质量管理体系考核,由FDA根据产品风险等级,管理要求和市场反馈等因素综合决定。
而NMPA则对三类不同器械进行了不同的划分。针对第一类器械,则要求境内生产企业在所在地设区的市级药监局进行注册备案和生产许可备案。针对第二类器械,境内生产企业需要在所在地省(直辖市)药监局进行注册申请、产品检验(经国家认可的检测机构监测)、临床评价(是否实施需依据管理要求进行)、质量体系考核。针对第三类器械,境内医疗器械生产企业需要在国家药监局进行注册申请,产品检验(经国家认可的检测机构监测)、产品临床试验/评价(如有规定可申请免临床)、质量体系考核。
一般来说,FDA将影像类产品定为Ⅱ类,侵入类产品定为Ⅲ类。根据是否已有类似的产品可以对照以及具体的风险是否足够了解和可控,二类批准又分为De Novo、510(k)、PMA等。而国内用于辅助决策的AI产品必须获得三类认证。
统计2018年1月至2019年12月这一区间的数据,共有超过35款AI产品通过了审批,其通过的方式无外于De Novo、510(k)等途径。不过,这里面通过的产品聚集于非辅助诊断类产品,仅IDx旗下的IDx-DR、Aidoc旗下的CT产品等少数几款产品与国内定义的辅助诊断近似,且获批的所有产品,无一与国内企业有关。
因此,推想科技AI肺部产品通过FDA审批这一事件几乎可以看做AI企业出海的里程碑,在基于ClearRead CT通过510(k)获得FDA认证之后,推想科技不仅能够更快的速度推进商业化,在拥有首次审批经验后,更多的产品也将接踵而至。
要谈审批的意义就必须先谈AI产品本身的价值,AI产品不能脱离市场而活,而推想科技看准的便是美国庞大的肺癌筛查需求。
据推想科技提供的数据显示,肺癌是美国第二大癌症,也是癌症死亡率最高的癌种之一,大约25%的癌症死亡案例来自于肺癌。美国国立卫生研究院 (NIH)预计,2020年全美肺癌死亡病例将为135,720,占比22.4%,5年存活率为20.5%。
在肺癌居高不下并逐年增长的背景下,美国启动了LCS项目。该项目针对目前尚无症状的肺癌高风险人群进行早期筛查,使用低剂量CT进行肺部影像检查,旨在做到肺癌的早发现、早诊治,提高生存率。
目前,美国医疗保险和医疗辅助服务中心(CMS)已经将LCS纳入医保系统,这意味着,美国的医保机构有意愿推动医疗机构购置AI系统,以提升肺癌检出率,在患者患病早期便对肺癌进行处理,这将加大提高患者的生存率,并大幅降低医保支出。
因此,对于推想而言,通过审批意味着他们不仅可以和美国ACR注册的1700+多家提供LCS服务的医院、影像中心以及前后端企业进行商业合作,挖掘LCS项目的商业机会,还可以为北美的各类医疗机构、影像中心在肺部疾病筛查项目上提供AI助力。
事实上,推想AI已经与北美多家顶级医疗机构进行广泛合作,其中不乏马里兰大学医学中心、杰斐逊医院等美国顶级医疗机构。认证之后,推想科技的商业拓展之旅无疑会进一步加速。
回忆起整个审批流程,推想科技的工作人员按耐不住语调中的兴奋:“9个月的时间实在算不上长,本以为还有一个多月才会拿到证书,没想到FDA突然就为我们带来了好消息。”
在2019年10月完成美国临床试验后,推想科技便正式递交了FDA 510(k)审批申请。“其中的过程并非一帆风顺,在递交申请后的两个月,FDA向推想科技反馈了一些文件中的问题,在疫情肆掠的2月,我们的团队一部分忙于新冠肺炎的AI产品研发,一部分则开始为FDA审批补充材料,两条路线都朝着好的方向在发展,我们最终在7月份通过了AI肺结节产品的审批。”
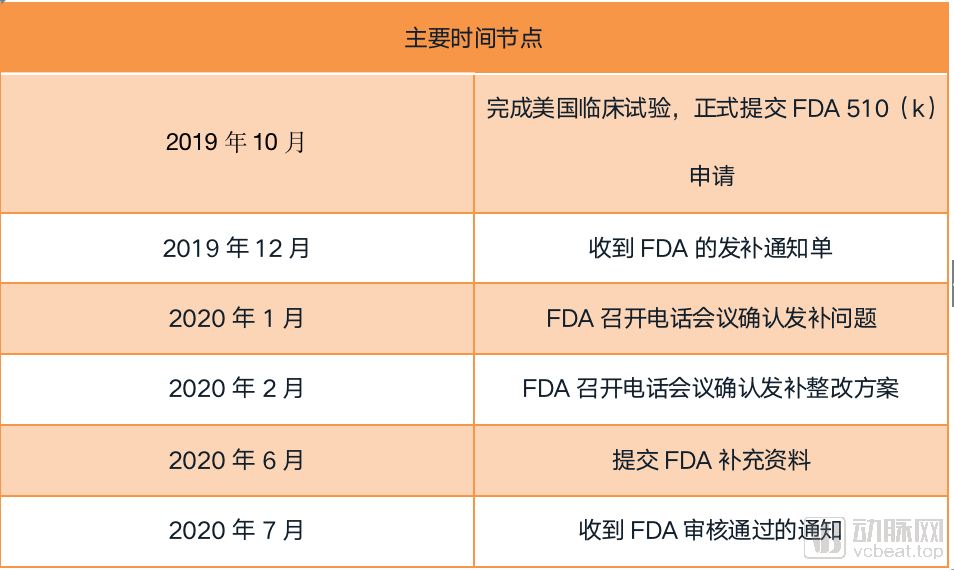
回顾整个流程,推想科技把获得FDA的经验总结为以下6点:
1. 构造经得起考验的AI产品,这需要长期技术积累与优秀研发人员的产品能力。
2. 构造具备国际经验的专业认证团队。
3. 研发并非独立的一部分,需要研发、产品、科研、认证等各团队协同作战。
4. 对同类肺部AI产品和FDA法规进行深入研究,这要求团队熟悉FDA对于同类产品的相关法规要求。
5. 推想曾通过Pre-submission与FDA提前沟通关键问题,并因此获得先发优势。
6. 收到FDA发补后,推想以最快的速度通过Q-sub(SIR)途径争取确认清楚FDA的具体要求再进行补正。
总结各部分的审批经验并不困难,但实行起来实则不易,无论是产品还是团队,都是在推想科技多年深耕于医疗AI后,不断锤炼而成,而这也成为了推想科技最为坚实的壁垒。
早在2017年,推想科技就完成了在美国,日本,德国的国际部署,并在接下来的一年间,成功为日本、德国的医院部署AI肺部产品。
3年之后,推想在国际战线的打法显得更为成熟,两线并行,一条瞄准德国、美国、日本等发达国家;另一条则顺着新世纪的丝绸之路,向中东、非洲的国家传递先进的医学人工智能技术。
目前,推想海外团队已经通过这两条线路覆盖了十个国家,各个团队参与国际项目,推进的领域包括癌症的早诊早治AI网络、传染性疾病的防控AI体系和AI基础设施建设等。
面向不同国家的产品必然面对要求不同的审批,推想科技无疑在这方面做足了工作。
2020年2月24日,推想科技的人工智能产品InferRead通过了欧盟CE认证,成为欧洲首个获得认证的胸部AI产品,也算是为2018年进入欧洲市场的推想团队成绩单打出了完美的分数。
在欧洲,推想AI同样经历了从质疑到认可的过程,与合作医院建立充分的信任与深度合作。
欧洲有约5亿人口,如果参照美国的比率,存在约1400万的肺癌早筛人群,进行肺癌筛查将产生约数十亿欧元的肺癌AI市场。
同时,欧洲对于肺癌早筛的重视程度正在不断提高,如果肺癌能够做到早期发现早期治疗,将为整个医疗体系节约巨大的医疗成本。因此,尽管欧洲大多数医院流程规范、水平较高,但仍然认为推想AI是不可或缺的临床辅助工具以及科研基础平台
同年6月,推想科技又获得日本PMDA准入资质。针对新冠疫情的推想肺炎AI产品成为日本PMDA批准的首个新冠AI辅助诊断产品,也是PMDA批准的首个肺部AI辅助诊断产品。
种种成就均在佐证推想AI获得FDA审批并非偶然性,正是因为长期的投入,终究才收获了今日的成果。
回顾2020这半年,过去数年来桎梏医学影像人工智能发展的链条已经逐渐解开。一月科亚医疗CT-FFR 率先突破重围;成为首个通过药监局三类器械审批的AI企业,随后乐普医疗紧随其后,旗下医疗AI心电分析软件获得三类证书;六月安德医智MR人工智能产品获批,拿到国内首张AI“影像辅助诊断”软件三类证。种种成就引得行业重拾对于医疗AI的关注,而如今,推想肺部AI获得FDA认证,人工智能海外商业化的灯塔有望由此建立。
不过,阻碍AI企业发展的障碍并非仅是各个国家的审评审批,作为企业,必须考虑场景的需求,考虑医院是否存在买单的意愿,才能防止许多AI医疗器械“过审即过气”的悲剧。
因此,无论审批如何,能够在市场上存活与否,能够被医生接受与否,其关键,仍然在于人工智能价值本身。推想科技抓住了北美的需求,在他们眼中,审批固然重要,但仅是产品研发中的插曲——找到场景,并实现商业落地才是最终的目的。
此外,推想科技获FDA审批一事,其意义并非仅仅局限于行业之中,事实上,在中美关系存在诸多不确定性的当下,推想FDA认证的获批,再次证明了医疗没有国界,技术没有国界。
这张FDA证书同样能够很好的代表了全球医疗AI企业获得的成绩。正如推想科技创始人兼CEO陈宽所言:“这个认证被赋予了更大的历史意义,我们坚信,即便是在今天,中美民生科技的交流和融合仍然可以实现,也应该有人来推动交流与融合的实现。推想仅是其中之一,但毫无疑问,我们将继续砥砺前行。”